Vue d’ensemble du marché :
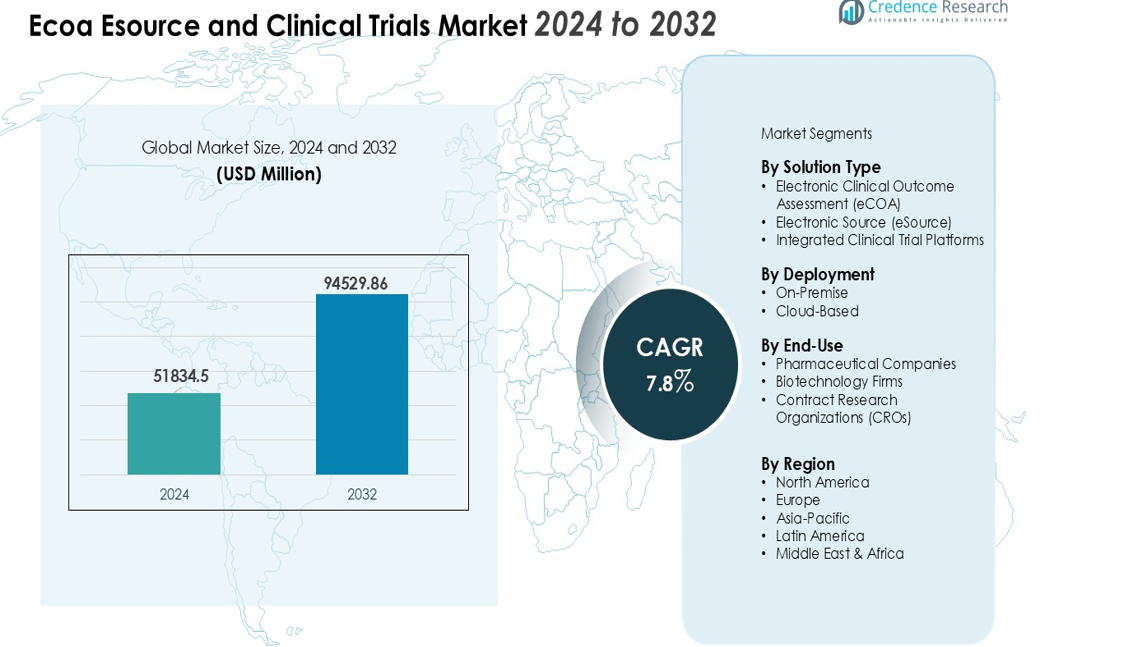
La taille du marché des essais cliniques et des sources électroniques (Ecoa Esource) était évaluée à 51 834,5 millions USD en 2024 et devrait atteindre 94 529,86 millions USD d’ici 2032, avec un TCAC de 7,8 % pendant la période de prévision (2024-2032).
| ATTRIBUT DU RAPPORT |
DÉTAILS |
| Période Historique |
2020-2023 |
| Année de Base |
2024 |
| Période de Prévision |
2025-2032 |
| Taille du Marché des Essais Cliniques, eCOA et eSource 2024 |
51 834,5 millions USD |
| Marché des Essais Cliniques, eCOA et eSource, TCAC |
7,8 % |
| Taille du Marché des Essais Cliniques, eCOA et eSource 2032 |
94 529,86 millions USD |
Les principaux moteurs du marché incluent l’augmentation du volume et de la complexité des essais cliniques dans le monde, nécessitant une collecte de données électroniques rationalisée, une surveillance en temps réel et une gestion sécurisée des données. Le passage aux essais cliniques décentralisés et centrés sur le patient, rendu possible par la surveillance à distance, les dispositifs portables, les applications mobiles de santé et les plateformes électroniques basées sur le cloud, a encore accéléré l’adoption des solutions eCOA et eSource. De plus, l’encouragement réglementaire pour les évaluations électroniques des résultats cliniques et le besoin croissant d’intégrité, de transparence et d’efficacité des données renforcent l’expansion du marché.
Régionalement, l’Amérique du Nord mène le marché, soutenue par une infrastructure avancée de R&D pharmaceutique, une adoption précoce des technologies et des cadres réglementaires favorables. Pendant ce temps, l’Asie-Pacifique émerge comme la région à la croissance la plus rapide en raison de l’augmentation des activités de recherche clinique, de l’externalisation des essais et de l’adoption de solutions de gestion d’essais numériques, présentant des opportunités de croissance significatives pour le marché.
Aperçu du marché :
- Le marché des Ecoa Esource et des essais cliniques était évalué à 51 834,5 millions USD en 2024 et devrait atteindre 94 529,86 millions USD d’ici 2032, avec une croissance à un TCAC de 7,8 %.
- La complexité croissante et le volume des essais cliniques mondiaux stimulent la demande de solutions numériques permettant la capture de données en temps réel, réduisant les erreurs et assurant la conformité aux protocoles.
- Les essais décentralisés et centrés sur le patient accélèrent l’adoption des solutions eCOA et eSource, soutenus par les dispositifs portables, les applications de santé mobile et les plateformes de surveillance à distance.
- Le soutien réglementaire aux évaluations électroniques des résultats cliniques renforce l’adoption du marché, permettant des données d’essai précises, traçables et auditées.
- L’accent mis sur l’intégrité des données, la transparence et l’efficacité opérationnelle motive les entreprises pharmaceutiques et biotechnologiques à adopter des plateformes intégrées de gestion des essais numériques.
- Les coûts élevés de mise en œuvre, l’intégration complexe avec les systèmes existants et les exigences strictes en matière de confidentialité des données posent des défis à l’adoption généralisée.
- Régionalement, l’Amérique du Nord est en tête avec 42 % de part de marché grâce à une infrastructure de R&D avancée, l’Europe détient 28 % soutenue par l’harmonisation réglementaire, et l’Asie-Pacifique représente 20 % et croît le plus rapidement en raison de l’augmentation des activités de recherche clinique et de l’externalisation.
Access crucial information at unmatched prices!
Request your sample report today & start making informed decisions powered by Credence Research Inc.!
Download Sample
Moteurs du marché :
Complexité croissante et volume des essais cliniques stimulant l’adoption de solutions numériques
L’augmentation de la complexité et du volume des essais cliniques à l’échelle mondiale a créé un besoin fort de solutions numériques. Les sponsors nécessitent une collecte de données précise et en temps réel pour assurer l’efficacité des essais et la sécurité des patients. Le marché des eCOA, eSource et des essais cliniques bénéficie de sa capacité à rationaliser la gestion des données sur plusieurs sites. Il réduit les erreurs de saisie de données et accélère l’adhésion aux protocoles. Cette efficacité aide les organisations à répondre aux exigences réglementaires tout en gérant des études plus vastes et plus complexes.
- Par exemple, Medable, un pionnier des essais cliniques décentralisés, intègre les technologies de télésanté, ePRO et de surveillance à distance, permettant un accès en temps réel aux données et une collaboration entre sites, ce qui a permis de réduire de 30 % les visites sur site dans les études récentes.
Transition vers des essais cliniques décentralisés et centrés sur le patient augmentant la demande du marché
Les essais cliniques se dirigent vers des modèles décentralisés, axés sur la commodité du patient et la participation à distance. Cela permet la capture de données à partir de dispositifs portables, d’applications de santé mobile et de systèmes de surveillance à domicile. Le marché des eCOA, eSource et des essais cliniques soutient cette transformation en fournissant un accès sécurisé et en temps réel aux résultats rapportés par les patients. Les organisations gagnent en flexibilité et en engagement avec les participants. Cette tendance augmente la demande pour des plateformes d’essais cliniques numériques capables de surveillance à distance.
- Par exemple, Science 37, sa solution de recrutement de patients a permis aux clients d’inscrire 42 % d’une cohorte d’essai en huit semaines pour une étude sur une maladie rare. L’entreprise rapporte également que sa plateforme technologique accélère l’inscription jusqu’à 15 fois plus rapidement que les méthodes traditionnelles, fournissant 100 % de références médicalement qualifiées.
Encouragement réglementaire pour les évaluations électroniques des résultats cliniques stimulant la mise en œuvre
Les agences réglementaires soutiennent de plus en plus les méthodes électroniques pour les évaluations des résultats cliniques. Cela améliore la précision, la traçabilité et l’auditabilité des données d’essai. La conformité à ces réglementations est essentielle pour les approbations d’essais mondiaux. Le marché des eCOA, eSource et essais cliniques fournit des solutions électroniques standardisées pour satisfaire ces exigences. Les entreprises bénéficient d’un examen réglementaire plus rapide et d’un risque réduit de divergences de données.
Accent croissant sur l’intégrité des données, la transparence et l’efficacité opérationnelle
Les entreprises pharmaceutiques et biotechnologiques privilégient l’intégrité des données et l’efficacité opérationnelle dans les essais cliniques. Cela garantit des résultats fiables et maintient la crédibilité du sponsor. Le marché des eCOA, eSource et essais cliniques permet une capture de données cohérente, un stockage sécurisé et un reporting simplifié. Les organisations réduisent les erreurs manuelles et gagnent du temps lors de l’analyse. Cet accent sur des données de haute qualité et transparentes continue de stimuler l’adoption de solutions de gestion d’essais numériques.
Tendances du marché :
Intégration de technologies numériques avancées améliorant l’efficacité des essais cliniques
Le marché des eCOA, eSource et essais cliniques montre une forte tendance vers l’intégration de technologies numériques avancées, y compris l’informatique en nuage, l’intelligence artificielle et l’apprentissage automatique. Cela permet aux sponsors d’analyser de grands volumes de données cliniques en temps réel et d’identifier des schémas qui soutiennent une prise de décision plus rapide. Les dispositifs de surveillance à distance des patients et les applications mobiles fournissent des flux de données continus directement aux bases de données d’essais. Cela réduit les retards opérationnels et améliore la conformité au protocole sur plusieurs sites d’étude. Les organisations s’appuient de plus en plus sur ces technologies pour améliorer la qualité des essais et minimiser les coûts. Les outils de visualisation des données et les fonctionnalités de reporting automatisé aident les parties prenantes à surveiller efficacement l’avancement des essais.
- Par exemple, la plateforme WeTrials permet un accès à distance des patients et fournit des ressources éducatives et des conseils personnalisés pour aider les participants à trouver et naviguer dans les essais cliniques, démontrant un effort pour améliorer l’engagement des patients et rationaliser les opérations dans les études multi-sites.
Expansion des essais décentralisés et accent sur les approches centrées sur le patient
Les essais cliniques décentralisés continuent de gagner en popularité, mettant l’accent sur la commodité des patients et la participation à distance. Le marché des eCOA, eSource et essais cliniques soutient ces essais en fournissant des solutions sécurisées de capture et de gestion des données électroniques. Cela permet une saisie directe des patients via des appareils mobiles, des capteurs portables et une surveillance à domicile, assurant un accès en temps réel pour les enquêteurs. Cette approche améliore l’engagement et la rétention des patients tout en maintenant l’intégrité des données. Les sponsors adoptent des plateformes qui permettent l’intégration de multiples sources de données pour une vue holistique des résultats des essais. Les plateformes d’essais numériques facilitent un recrutement plus rapide et élargissent l’accès à des populations de patients diversifiées. La tendance du marché reflète un mouvement soutenu vers des stratégies de recherche clinique plus flexibles, axées sur la technologie et centrées sur le patient.
- Par exemple, Science 37 construit des réseaux d’essais décentralisés mondiaux facilitant le recrutement diversifié de patients, menant à un accès plus large et à une robustesse améliorée des résultats.
Analyse des Défis du Marché :
Coûts Élevés de Mise en Œuvre et Intégration Complexe Freinant l’Adoption
Le marché des eCOA, eSource et des essais cliniques fait face à des défis liés aux coûts élevés de mise en œuvre et à la complexité de l’intégration des solutions numériques dans les flux de travail cliniques existants. Cela nécessite un investissement significatif dans l’infrastructure technologique, la formation du personnel et la maintenance continue. Les petites organisations trouvent souvent l’adoption financièrement contraignante. La migration des données à partir de systèmes hérités peut retarder le déploiement et perturber les essais en cours. Les problèmes de compatibilité avec divers systèmes électroniques peuvent affecter le flux de données sans faille. Ces obstacles ralentissent l’adoption généralisée malgré les avantages d’une efficacité accrue et d’une précision des données.
Préoccupations en Matière de Confidentialité des Données, de Conformité Réglementaire et de Sécurité Limitant la Croissance
La confidentialité des données et la conformité réglementaire restent des défis critiques pour le marché des eCOA, eSource et des essais cliniques. Il doit respecter des normes strictes pour la confidentialité des patients, la protection des données et le transfert d’informations transfrontalières. Toute violation de la sécurité peut saper la confiance et entraîner des sanctions réglementaires. Les variations des réglementations entre les régions compliquent la gestion des essais pour les études multinationales. Les organisations doivent investir dans des mesures de cybersécurité robustes et des protocoles de conformité. La gestion de grands volumes de données cliniques sensibles tout en maintenant l’exactitude et l’accessibilité ajoute de la complexité opérationnelle. Ces défis contraignent la croissance du marché et nécessitent une planification stratégique pour une mise en œuvre sécurisée et conforme.
Opportunités du Marché :
L’Expansion des Essais Cliniques Décentralisés et à Distance Créant un Potentiel de Croissance
Le marché des eCOA, eSource et des essais cliniques présente des opportunités significatives grâce à l’expansion des essais cliniques décentralisés et à distance. Il permet aux sponsors d’atteindre des populations de patients plus larges et de réduire les barrières géographiques dans le recrutement des essais. Les plateformes numériques soutiennent la capture de données en temps réel à partir de dispositifs portables, d’applications mobiles et de systèmes de surveillance à domicile. Les organisations peuvent améliorer l’engagement et la rétention des patients tout en maintenant des données de haute qualité. L’intégration de multiples sources de données permet une analyse complète des résultats des essais. La demande croissante pour des conceptions d’essais flexibles et centrées sur le patient offre un potentiel de marché soutenu.
L’Adoption d’Analyses Avancées et de l’Intelligence Artificielle Améliorant les Perspectives du Marché
L’adoption croissante d’analyses avancées, d’intelligence artificielle et d’apprentissage automatique offre des opportunités supplémentaires pour le marché des eCOA, eSource et des essais cliniques. Cela permet un traitement efficace de grands volumes de données cliniques et l’identification d’informations prédictives. Les sponsors peuvent optimiser la conception des essais, surveiller la sécurité des patients et accélérer la prise de décision. L’automatisation des rapports et de la gestion des risques améliore l’efficacité opérationnelle. L’intérêt croissant pour les preuves du monde réel et les biomarqueurs numériques soutient une intégration technologique accrue. Ces avancées positionnent le marché pour une croissance continue et une innovation dans la recherche clinique.
Analyse de la Segmentation du Marché :
Par Type de Solution
Le marché des eCOA, eSource et essais cliniques est segmenté par type de solution en évaluation électronique des résultats cliniques (eCOA), source électronique (eSource) et plateformes intégrées d’essais cliniques. Il permet aux organisations de choisir des solutions en fonction de la complexité des essais et des exigences en matière de données. Les solutions eCOA dominent l’adoption en raison de leur capacité à capturer efficacement les résultats rapportés par les patients et à maintenir l’intégrité des données. Les plateformes eSource soutiennent la capture directe des données à partir des dossiers médicaux électroniques, réduisant les erreurs manuelles et accélérant les délais des essais. Les plateformes intégrées offrent une gestion complète des essais, combinant la collecte de données, la surveillance et le reporting dans un système unifié. Ces solutions améliorent l’efficacité opérationnelle et la qualité globale des essais.
- Par exemple, la plateforme numérique ICON intègre des modules eConsent, eCOA, eSource et de téléconsultation pour faciliter les essais cliniques décentralisés, entraînant une amélioration de 20 % de l’engagement des patients et une réduction de 15 % des complexités opérationnelles des essais.
Par mode de déploiement
Le déploiement sur le marché des eCOA, eSource et essais cliniques inclut des solutions sur site et basées sur le cloud. Il offre une flexibilité pour répondre aux besoins spécifiques en matière d’infrastructure et de sécurité des différentes organisations. Le déploiement basé sur le cloud domine le marché en raison de sa scalabilité, de son accessibilité à distance et de ses coûts réduits de gestion informatique. Le déploiement sur site reste pertinent pour les organisations nécessitant un contrôle total sur le stockage des données et les systèmes internes. Les deux types de déploiement permettent un accès en temps réel aux données et soutiennent les modèles d’essais décentralisés. L’adoption dépend de la taille des essais, de la sensibilité des données et des capacités informatiques de l’organisation.
- Par exemple, la plateforme Castor eCOA atteint 90 % de la complétion des tests d’acceptation par les utilisateurs en 4 semaines, maintenant une validation robuste dans un environnement moderne et natif du cloud.
Par utilisation finale
Les segments d’utilisation finale incluent les entreprises pharmaceutiques, les sociétés de biotechnologie et les organisations de recherche sous contrat (CRO). Ils aident les sponsors à gérer des essais complexes, à assurer la conformité réglementaire et à accélérer le développement de médicaments. Les entreprises pharmaceutiques détiennent la plus grande part en raison des investissements élevés en R&D et du besoin de solutions numériques efficaces. Les CRO adoptent de plus en plus ces plateformes pour fournir des services évolutifs à plusieurs sponsors. Les sociétés de biotechnologie tirent parti des solutions eCOA et eSource pour améliorer les essais centrés sur le patient et améliorer la précision des données. La croissance du marché s’aligne sur l’expansion des activités de recherche clinique chez ces utilisateurs finaux.
Segmentations :
Par type de solution
- Évaluation Électronique des Résultats Cliniques (eCOA)
- Source Électronique (eSource)
- Plateformes Intégrées d’Essais Cliniques
Par déploiement
- Sur Site
- Basé sur le Cloud
Par utilisation finale
- Entreprises Pharmaceutiques
- Sociétés de Biotechnologie
- Organisations de Recherche sous Contrat (CRO)
Région
- Amérique du Nord
- États-Unis
- Canada
- Mexique
- Europe
- Allemagne
- France
- Royaume-Uni
- Italie
- Espagne
- Reste de l’Europe
- Asie-Pacifique
- Chine
- Japon
- Inde
- Corée du Sud
- Asie du Sud-Est
- Reste de l’Asie-Pacifique
- Amérique latine
- Brésil
- Argentine
- Reste de l’Amérique latine
- Moyen-Orient & Afrique
- Pays du CCG
- Afrique du Sud
- Reste du Moyen-Orient et de l’Afrique
Analyse régionale :
L’Amérique du Nord en tête grâce à une infrastructure pharmaceutique avancée
L’Amérique du Nord représente 42% du marché mondial des eCOA, eSource et essais cliniques, reflétant son leadership dans la recherche clinique et les technologies d’essais numériques. La région maintient une forte présence de grandes entreprises pharmaceutiques et de fournisseurs de technologies. Elle bénéficie d’une infrastructure de recherche bien établie et de cadres réglementaires qui encouragent les évaluations électroniques des résultats cliniques. Cela permet une capture, un stockage et un rapport de données efficaces sur plusieurs sites d’essais. Les investissements élevés dans la recherche clinique et l’adoption précoce de plateformes d’essais innovantes renforcent sa position sur le marché. Les sponsors comptent sur ces solutions pour assurer la conformité, améliorer l’engagement des patients et accroître l’efficacité opérationnelle.
L’Europe stimule la croissance grâce au soutien réglementaire et à l’intégration technologique
L’Europe détient 28% du marché mondial des eCOA, eSource et essais cliniques, soutenue par des normes réglementaires harmonisées et une adoption croissante des solutions cliniques numériques. La région facilite la collaboration transfrontalière pour les études multinationales et promeut des plateformes électroniques standardisées. Elle permet aux sponsors d’intégrer la surveillance à distance des patients, le rapport en temps réel et la gestion centralisée des données. Les investissements dans les essais centrés sur le patient et décentralisés améliorent encore l’efficacité opérationnelle. Elle renforce la qualité des essais, accélère les délais d’étude et soutient divers domaines thérapeutiques à travers le continent.
L’Asie-Pacifique émerge comme la région à la croissance la plus rapide avec une recherche clinique en expansion
L’Asie-Pacifique représente 20% du marché mondial des eCOA, eSource et essais cliniques et affiche le taux de croissance le plus élevé parmi toutes les régions. L’expansion rapide de la recherche clinique, la sous-traitance des essais et l’augmentation de la fabrication pharmaceutique stimulent l’adoption. Elle offre un accès à de grandes populations de patients diversifiées, permettant une exécution rentable des essais. Les plateformes numériques soutiennent la collecte de données en temps réel, la surveillance à distance et le rapport simplifié. Les initiatives gouvernementales promouvant l’adoption de la technologie et la sécurité des données renforcent le développement du marché. La région offre des opportunités substantielles pour une croissance à long terme et l’innovation dans les essais cliniques.
Shape Your Report to Specific Countries or Regions & Enjoy 30% Off!
Analyse des acteurs clés :
- Medidata Solutions, Inc.
- Oracle Corporation
- Veeva Systems Inc.
- Parexel International Corporation
- CRF Health (désormais partie de Medidata)
- BioClinica, Inc.
- ERT (eResearchTechnology)
- ICON plc
- IQVIA Holdings, Inc.
- Signant Health
- YPrime, LLC
- ClinOne
Analyse concurrentielle :
Le marché des eCOA, eSource et essais cliniques est hautement concurrentiel, stimulé par la présence de fournisseurs de technologies établis et d’organisations de recherche sous contrat offrant des solutions numériques avancées. Les acteurs clés se concentrent sur l’innovation produit, les partenariats stratégiques et l’expansion géographique pour renforcer leurs positions sur le marché. L’accent est mis sur l’intégration de plateformes basées sur le cloud, d’analyses pilotées par l’IA et d’outils centrés sur le patient pour différencier les offres. Les entreprises investissent dans des solutions évolutives qui soutiennent les essais décentralisés, la capture de données en temps réel et la conformité réglementaire. Les stratégies concurrentielles incluent des acquisitions, des collaborations avec des sponsors pharmaceutiques et l’amélioration des portefeuilles de services pour fournir une gestion d’essai de bout en bout. Les leaders du marché priorisent le soutien client et la formation pour assurer une adoption fluide de leurs plateformes. Les petites entreprises tirent parti de solutions de niche ou de services spécialisés pour capturer des segments de marché ciblés. Dans l’ensemble, la concurrence encourage l’innovation continue, l’amélioration de l’efficacité opérationnelle et l’amélioration de la qualité des essais sur le marché mondial.
Développements récents :
- En octobre 2025, Medidata Solutions, Inc. a élargi son partenariat avec Sanofi pour approfondir la collaboration sur le développement clinique activé par l’IA.
- En mars 2025, ICON plc a formé un partenariat avec Mural Health Technologies, Inc. pour améliorer l’expérience des participants et des sites d’essais cliniques, en utilisant la plateforme de Mural Link pour les paiements, la coordination des voyages et la communication, facilitant la gestion des essais centrés sur le patient et réduisant les barrières à la participation.
Couverture du rapport :
Le rapport de recherche offre une analyse approfondie basée sur le type de solution, le déploiement, l’utilisation finale et la région. Il détaille les principaux acteurs du marché, fournissant un aperçu de leur activité, de leurs offres de produits, de leurs investissements, de leurs sources de revenus et de leurs applications clés. De plus, le rapport inclut des informations sur l’environnement concurrentiel, l’analyse SWOT, les tendances actuelles du marché, ainsi que les principaux moteurs et contraintes. En outre, il discute de divers facteurs qui ont stimulé l’expansion du marché ces dernières années. Le rapport explore également la dynamique du marché, les scénarios réglementaires et les avancées technologiques qui façonnent l’industrie. Il évalue l’impact des facteurs externes et des changements économiques en ITALIE sur la croissance du marché. Enfin, il fournit des recommandations stratégiques pour les nouveaux entrants et les entreprises établies afin de naviguer dans les complexités du marché.
Perspectives d’avenir :
- L’adoption croissante des essais cliniques décentralisés et centrés sur le patient stimulera la croissance du marché.
- L’intégration de l’intelligence artificielle et des analyses avancées améliorera la prise de décision basée sur les données.
- Les plateformes basées sur le cloud domineront le déploiement en raison de leur évolutivité, flexibilité et accès à distance.
- L’expansion sur les marchés émergents, en particulier en Asie-Pacifique, créera de nouvelles opportunités de croissance.
- Le soutien réglementaire pour les évaluations électroniques des résultats cliniques accélérera l’adoption des solutions numériques.
- Un accent accru sur la surveillance en temps réel et l’intégrité des données stimulera l’investissement dans les solutions eCOA et eSource.
- La collaboration entre les fournisseurs de technologies et les entreprises pharmaceutiques améliorera l’efficacité des essais.
- La demande croissante pour les dispositifs portables et les applications de santé mobile renforcera les capacités des essais numériques.
- Le développement de plateformes intégrées offrant une gestion complète des essais gagnera en popularité.
- L’innovation continue dans les outils d’automatisation, de reporting et de conformité soutiendra l’expansion à long terme du marché.




