Aperçu du Marché
Le marché des essais cliniques in silico était évalué à 3 588 millions USD en 2024 et devrait atteindre 6 313,87 millions USD d’ici 2032, avec un taux de croissance annuel composé (CAGR) de 7,32 % sur la période de prévision.
| ATTRIBUT DU RAPPORT |
DÉTAILS |
| Période Historique |
2020-2023 |
| Année de Base |
2024 |
| Période de Prévision |
2025-2032 |
| Taille du Marché des Essais Cliniques In Silico 2024 |
3 588 millions USD |
| Marché des Essais Cliniques In Silico, CAGR |
7,32 % |
| Taille du Marché des Essais Cliniques In Silico 2032 |
6 313,87 millions USD |
Le marché des essais cliniques in silico est dirigé par un groupe d’entreprises spécialisées en technologie et en analyse des sciences de la vie qui fournissent des plateformes avancées de modélisation, de simulation et d’IA. Des acteurs clés tels que Dassault Systèmes SE, Certara, Inc., Insilico Medicine, Inc., GNS Healthcare Inc., Novadiscovery SAS, InSilicoTrials, Immunetrics Inc., Nuventra Pharma Sciences, Abzena Ltd., et The AnyLogic Company rivalisent sur la précision prédictive, la validation conforme aux réglementations et l’intégration dans les flux de travail de développement de médicaments et de dispositifs. Ces entreprises soutiennent les sponsors pharmaceutiques et de dispositifs médicaux dans l’optimisation de la conception des essais, la sélection des doses et la stratification des patients. L’Amérique du Nord reste le principal marché régional, représentant environ 38 % de la part de marché mondiale, stimulée par de forts investissements en R&D, une adoption précoce de la technologie et un engagement réglementaire favorable.
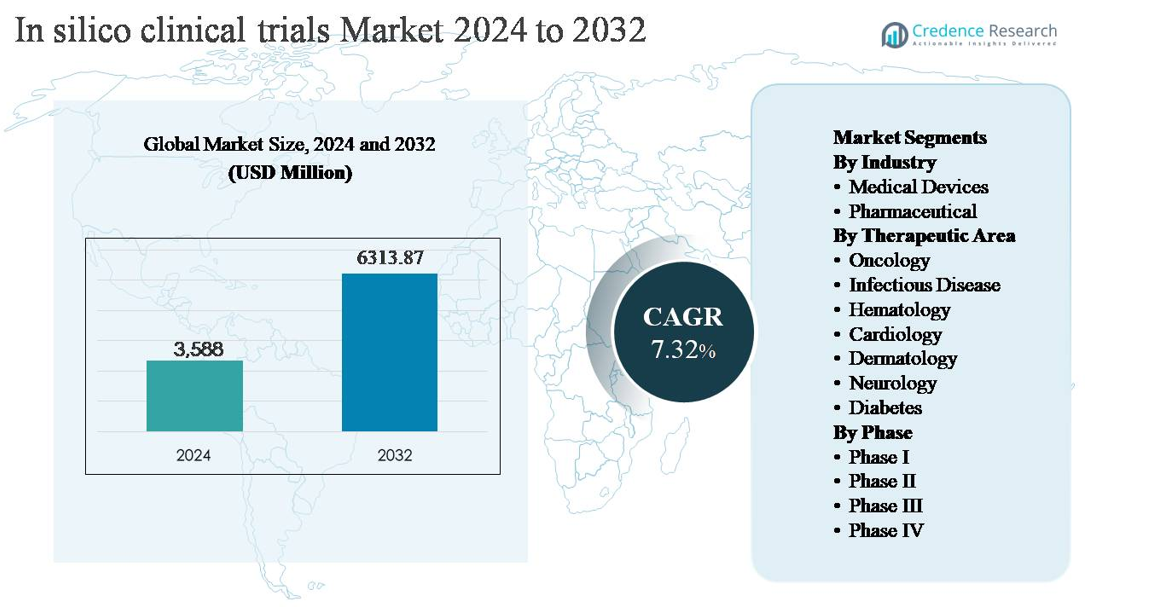
Aperçus du Marché
- Le marché des essais cliniques in silico était évalué à 3 588 millions USD en 2024 et devrait atteindre 6 313,87 millions USD d’ici 2032, avec un taux de croissance annuel composé (CAGR) de 7,32 % pendant la période de prévision.
- La croissance du marché est principalement stimulée par l’augmentation des coûts et de la complexité des essais cliniques conventionnels, poussant les entreprises pharmaceutiques et de dispositifs médicaux à adopter des approches basées sur la simulation pour réduire les délais de développement, optimiser les protocoles et améliorer les taux de réussite des essais, le segment pharmaceutique détenant la part dominante en raison d’une activité de R&D de médicaments intensive.
- Les principales tendances du marché incluent l’intégration croissante de l’IA, de l’apprentissage automatique et des technologies de jumeaux numériques, ainsi que l’utilisation croissante en oncologie et en cardiologie, où l’oncologie reste le principal segment thérapeutique en raison des risques élevés d’échec des essais et de la demande de modélisation de traitements personnalisés.
- Le paysage concurrentiel est marqué par des acteurs spécialisés offrant des plateformes de modélisation avancées, la concurrence se concentrant sur la précision prédictive, l’acceptation réglementaire et l’intégration de flux de travail de bout en bout grâce à des collaborations stratégiques avec des entreprises des sciences de la vie.
- Régionalement, l’Amérique du Nord est en tête avec environ 38 % de part de marché, suivie par l’Europe à 28 % et l’Asie-Pacifique à 22 %, tandis que l’Amérique latine et le Moyen-Orient & Afrique représentent collectivement la part restante, reflétant une adoption émergente.
Access crucial information at unmatched prices!
Request your sample report today & start making informed decisions powered by Credence Research Inc.!
Download Sample
Analyse de la Segmentation du Marché :
Par Industrie :
Le segment pharmaceutique représente la part dominante du marché des essais cliniques in silico, représentant la majorité des revenus globaux en raison de son utilisation extensive dans les pipelines de découverte de médicaments et de développement clinique. Les entreprises pharmaceutiques déploient de plus en plus la modélisation in silico pour optimiser la sélection des doses, prédire l’efficacité et réduire les échecs des essais en phase avancée, en particulier dans les programmes complexes de biologiques et de petites molécules. Le segment des dispositifs médicaux, bien que plus petit, se développe régulièrement à mesure que les agences réglementaires acceptent les preuves computationnelles pour la sécurité et la performance des dispositifs. La domination des produits pharmaceutiques est motivée par une intensité élevée de R&D, des coûts d’essais en hausse et une forte pression pour raccourcir les délais de développement.
- Par exemple, Novartis a documenté publiquement l’utilisation de plateformes QSP pour simuler les interactions médicament-maladie sur des cohortes virtuelles dépassant 10 000 patients modélisés pour les programmes d’immunologie et d’oncologie, permettant l’évaluation de multiples régimes et calendriers de doses avant les études de première administration chez l’homme.
Par domaine thérapeutique :
L’oncologie est le domaine thérapeutique dominant sur le marché des essais cliniques in silico, détenant la plus grande part de marché en raison de la haute complexité de la biologie du cancer et du besoin de modélisation de traitements personnalisés. Les simulations de tumeurs virtuelles, la stratification des biomarqueurs et les outils de prédiction de réponse sont largement utilisés pour optimiser la conception des essais et la sélection des patients. Les maladies infectieuses suivent, soutenues par la modélisation des épidémies et les applications de développement de vaccins, tandis que la cardiologie et la neurologie montrent une adoption croissante grâce aux simulations au niveau des organes. Le leadership en oncologie est motivé par des taux élevés d’échec clinique, la demande de médecine de précision et des dépenses substantielles en R&D en oncologie.
- Par exemple, Roche et sa division Genentech ont rapporté l’utilisation de modèles de pharmacologie des systèmes quantitatifs intégrant des données génomiques et pharmacologiques de plus de 11 000 échantillons de tumeurs dérivés de The Cancer Genome Atlas pour simuler l’inhibition des voies et prédire la variabilité de la réponse à travers des cohortes oncologiques virtuelles.
Par phase :
La phase II constitue le segment de phase dominant sur le marché des essais cliniques in silico, capturant la plus grande part de marché alors que les sponsors s’appuient de plus en plus sur les simulations pour évaluer les signaux d’efficacité et affiner les critères d’évaluation des essais. Les approches in silico sont particulièrement précieuses en phase II pour réduire le nombre de patients et améliorer les décisions de continuation/arrêt avant les essais coûteux en phase avancée. L’adoption de la phase I est soutenue par les simulations de sécurité et de détermination de dose, tandis que l’utilisation de la phase III se développe pour le complément des cohortes virtuelles. La domination de la phase II est motivée par son rôle critique dans la réduction de l’attrition et l’optimisation des coûts.
Principaux moteurs de croissance
Coût et complexité croissants des essais cliniques conventionnels
L’augmentation des coûts, des délais prolongés et des taux d’échec élevés dans les essais cliniques traditionnels sont un moteur principal accélérant l’adoption des essais cliniques in silico. Les études cliniques en phase avancée nécessitent de grandes cohortes de patients, une coordination multi-sites et une supervision réglementaire étendue, augmentant considérablement les dépenses de développement. Les approches in silico permettent aux sponsors de simuler les réponses des patients, de raffiner les critères d’inclusion et d’optimiser les stratégies de dosage avant le début des essais physiques. Ces capacités aident à réduire les amendements de protocole inutiles et à alléger les charges de recrutement des patients. En identifiant plus tôt les candidats inefficaces, les développeurs peuvent rediriger les ressources plus efficacement. La pression croissante sur les entreprises pharmaceutiques et de dispositifs médicaux pour contrôler les dépenses de R&D tout en maintenant la production d’innovation continue de pousser les essais in silico dans les stratégies de développement grand public.
- Par exemple, AstraZeneca a révélé l’utilisation de cadres de développement de médicaments informés par des modèles qui intègrent des modèles PBPK et de progression de la maladie pour simuler les résultats cliniques à travers des cohortes virtuelles dépassant 5 000 patients, permettant ainsi le raffinement des protocoles et l’optimisation des doses avant le lancement des essais de Phase III.
Avancées en Modélisation Computationnelle et Intelligence Artificielle
Les améliorations rapides en biologie computationnelle, apprentissage automatique et technologies de jumeaux numériques élargissent considérablement la portée et la fiabilité des essais cliniques in silico. Les algorithmes avancés peuvent désormais intégrer des ensembles de données génomiques, protéomiques et physiologiques pour créer des populations de patients virtuels hautement prédictives. Ces modèles permettent aux chercheurs de tester simultanément plusieurs scénarios d’essais, améliorant ainsi la précision de la prédiction des résultats. Les plateformes pilotées par l’IA améliorent également les conceptions d’essais adaptatifs en apprenant continuellement des données entrantes. À mesure que la précision de la modélisation s’améliore, la confiance réglementaire dans les preuves basées sur la simulation se renforce. La convergence de l’informatique haute performance et de l’IA permet une application plus large des méthodes in silico dans les domaines thérapeutiques et les phases d’essais.
- Par exemple, Siemens Healthineers a fait progresser les technologies de jumeaux numériques grâce à ses modèles de cœur computationnels, qui sont construits à l’aide de millions d’éléments finis pour simuler l’électrophysiologie cardiaque et l’hémodynamique dans diverses conditions pathologiques, soutenant ainsi l’évaluation virtuelle des thérapies et interventions cardiovasculaires.
Acceptation Réglementaire Croissante et Cadres de Soutien
Les agences réglementaires reconnaissent de plus en plus les preuves in silico comme un composant complémentaire de l’évaluation clinique, stimulant la croissance du marché. Les orientations réglementaires encouragent désormais l’utilisation de la modélisation computationnelle pour la validation des dispositifs, l’optimisation des doses et l’évaluation des risques. Les essais in silico aident à soutenir les soumissions réglementaires en fournissant des insights mécanistiques robustes et en réduisant la dépendance à des tests humains étendus. Ce changement est particulièrement évident dans le développement de dispositifs médicaux, où les tests virtuels peuvent démontrer la sécurité à travers plusieurs scénarios. À mesure que les régulateurs continuent de formaliser les normes pour la validation et le reporting des modèles, la confiance de l’industrie dans le développement piloté par simulation augmente, accélérant ainsi l’adoption.
Tendances Clés & Opportunités
Expansion des Applications de Médecine Personnalisée et de Précision
Les essais cliniques in silico sont de plus en plus alignés avec la croissance de la médecine personnalisée, créant des opportunités significatives pour l’expansion du marché. La modélisation de patients virtuels permet la stratification basée sur des données génétiques, phénotypiques et de biomarqueurs, soutenant un développement thérapeutique plus ciblé. Cette approche permet aux développeurs de simuler les réponses aux traitements à travers des sous-populations diverses, améliorant l’efficacité et les résultats des essais. La modélisation de précision est particulièrement précieuse en oncologie et dans les maladies rares, où l’hétérogénéité des patients limite les conceptions d’essais traditionnels. À mesure que les thérapies personnalisées gagnent en popularité, la demande pour des plateformes in silico sophistiquées capables de prédire des réponses individualisées devrait augmenter régulièrement.
- Par exemple, Moderna a exploité des plateformes de sélection de néoantigènes in silico pour ses programmes de vaccins personnalisés contre le cancer, en utilisant des pipelines informatiques pour prioriser jusqu’à 34 séquences de néoantigènes spécifiques au patient par profil tumoral individuel avant la fabrication clinique.
Intégration avec les Données du Monde Réel et les Technologies de Santé Numérique
L’intégration des données du monde réel provenant des dossiers de santé électroniques, des dispositifs portables et des plateformes de santé numérique représente une opportunité de croissance clé pour les essais cliniques in silico. Combiner des modèles de simulation avec des preuves du monde réel améliore la précision prédictive et soutient la surveillance post-commercialisation et les conceptions d’essais adaptatifs. Cette tendance permet un raffinement continu des modèles et une évaluation des résultats à long terme au-delà des environnements d’essais contrôlés. Les sponsors pharmaceutiques considèrent de plus en plus cette intégration comme une voie pour améliorer les soumissions réglementaires et les stratégies de gestion du cycle de vie. La disponibilité croissante de données de santé structurées devrait encore renforcer cette opportunité.
- Par exemple, le projet Baseline de Verily a combiné les sorties de capteurs portables, les mesures cliniques et les données EHR de 10 000 participants inscrits pour générer des ensembles de données longitudinales profondément phénotypées utilisées pour la modélisation de la progression des maladies et la génération de cohortes virtuelles.
Défis Clés
Validation des Modèles, Standardisation et Limitations de la Qualité des Données
Assurer l’exactitude, la reproductibilité et la pertinence clinique des modèles in silico reste un défi majeur. La variabilité des sources de données, des hypothèses et des techniques de modélisation peut conduire à des résultats incohérents entre les plateformes. L’absence de cadres de validation standardisés complique l’examen réglementaire et limite la comparabilité entre les études. Des ensembles de données de haute qualité et représentatifs sont essentiels pour des simulations fiables, mais l’accès à des données cliniques et biologiques complètes reste inégal. Aborder ces défis nécessite une collaboration entre l’industrie, les régulateurs et les fournisseurs de technologie pour établir des normes communes et des meilleures pratiques.
Expertise Technique Limitée et Barrières à l’Intégration
L’implémentation efficace des essais cliniques in silico nécessite une expertise spécialisée en biologie computationnelle, en science des données et en recherche clinique, dont beaucoup d’organisations manquent. L’intégration des plateformes de simulation dans les flux de travail R&D existants peut être complexe et gourmande en ressources. La résistance au changement au sein des équipes de développement clinique établies ralentit encore l’adoption. De plus, aligner les parties prenantes multidisciplinaires autour de la prise de décision basée sur les modèles présente des défis organisationnels. Surmonter ces barrières nécessitera un développement ciblé de la main-d’œuvre, des plateformes plus conviviales et une collaboration interfonctionnelle renforcée.
Analyse Régionale
Amérique du Nord
L’Amérique du Nord domine le marché des essais cliniques in silico, représentant environ 38 % de la part de marché mondiale. La région bénéficie d’une infrastructure de santé avancée, d’un investissement solide en R&D pharmaceutique et d’une adoption précoce de la modélisation informatique et des plateformes d’essais pilotées par l’IA. Les États-Unis dirigent la croissance régionale en raison de la présence de grandes entreprises pharmaceutiques, de fournisseurs de logiciels spécialisés et d’institutions de recherche académique utilisant activement des simulations de patients virtuels. Des orientations réglementaires favorables soutenant la modélisation et la simulation dans le développement de médicaments et de dispositifs renforcent encore l’adoption. Les coûts élevés des essais cliniques et la forte demande d’efficacité continuent de renforcer la position de leader de l’Amérique du Nord.
Europe
L’Europe détient près de 28 % de la part de marché mondiale des essais cliniques in silico, soutenue par un alignement réglementaire solide, des collaborations de recherche public-privé et une acceptation croissante des preuves numériques dans le développement clinique. Des pays comme l’Allemagne, le Royaume-Uni et la France sont des contributeurs clés, portés par des écosystèmes de recherche biomédicale robustes et des investissements croissants dans la médecine personnalisée. Les régulateurs européens soutiennent de plus en plus la modélisation et la simulation pour l’évaluation de la sécurité et l’optimisation des doses, en particulier dans les dispositifs médicaux. L’accent mis par la région sur la maîtrise des coûts, la conception éthique des essais et l’innovation en biologie computationnelle soutient une expansion régulière du marché.
Asie-Pacifique
L’Asie-Pacifique représente environ 22 % de la part de marché mondiale et constitue le marché régional à la croissance la plus rapide pour les essais cliniques in silico. L’expansion rapide de la fabrication pharmaceutique, l’augmentation de l’activité des essais cliniques et la hausse des investissements dans la santé numérique soutiennent l’adoption. La Chine, le Japon, la Corée du Sud et l’Inde sont des marchés clés, portés par des capacités computationnelles croissantes et des secteurs biotechnologiques en expansion. Les gouvernements de la région promeuvent l’innovation en santé basée sur l’IA et les données, accélérant l’utilisation des méthodologies d’essais virtuels. L’augmentation des volumes d’essais cliniques et la pression pour réduire les délais de développement continuent de stimuler une forte dynamique de croissance régionale.
Amérique Latine
L’Amérique Latine représente environ 7 % du marché mondial des essais cliniques in silico, avec une adoption progressive soutenue par l’expansion de l’activité de recherche clinique et l’amélioration des infrastructures de santé. Le Brésil et le Mexique sont les principaux contributeurs, soutenus par l’augmentation de l’externalisation pharmaceutique et la participation régionale aux essais. Bien que l’adoption reste limitée par rapport aux régions développées, une prise de conscience croissante des modèles d’essais rentables encourage l’intérêt pour les approches in silico. La croissance régionale est soutenue par des collaborations avec des sponsors mondiaux cherchant à optimiser les conceptions d’essais. Un investissement continu dans les capacités de santé numérique devrait renforcer la pénétration du marché au fil du temps.
Moyen-Orient & Afrique
La région du Moyen-Orient & Afrique détient environ 5 % de la part de marché mondiale, reflétant une adoption précoce des essais cliniques in silico. La croissance est soutenue par des initiatives de modernisation des soins de santé, en particulier dans les pays du Conseil de coopération du Golfe investissant dans la santé numérique et les infrastructures de recherche avancées. L’Afrique du Sud contribue également par l’expansion des capacités de recherche clinique. L’accès limité à des ensembles de données de haute qualité et à une expertise technique contraint actuellement l’adoption. Cependant, une participation croissante aux essais cliniques mondiaux et un intérêt croissant pour les solutions de santé basées sur l’IA devraient progressivement améliorer la présence du marché régional.
Segmentation du marché :
Par Industrie
- Dispositifs Médicaux
- Pharmaceutique
Par Domaine Thérapeutique
- Oncologie
- Maladies Infectieuses
- Hématologie
- Cardiologie
- Dermatologie
- Neurologie
- Diabète
Par Phase
- Phase I
- Phase II
- Phase III
- Phase IV
Par Géographie
- Amérique du Nord
- États-Unis
- Canada
- Mexique
- Europe
- Allemagne
- France
- Royaume-Uni
- Italie
- Espagne
- Reste de l’Europe
- Asie-Pacifique
- Chine
- Japon
- Inde
- Corée du Sud
- Asie du Sud-Est
- Reste de l’Asie-Pacifique
- Amérique latine
- Brésil
- Argentine
- Reste de l’Amérique latine
- Moyen-Orient & Afrique
- Pays du CCG
- Afrique du Sud
- Reste du Moyen-Orient et de l’Afrique
Paysage Concurrentiel
Le paysage concurrentiel du marché des essais cliniques in silico est caractérisé par un mélange de fournisseurs de logiciels de simulation spécialisés, de sociétés d’analyse pilotées par l’IA et d’entreprises technologiques établies dans les sciences de la vie. Les participants au marché se concurrencent sur la profondeur de la modélisation biologique, la précision prédictive et la capacité à intégrer des données multi-omiques et réelles dans des simulations de patients virtuels. Les acteurs principaux se concentrent sur l’expansion des capacités des plateformes dans plusieurs domaines thérapeutiques et phases cliniques, tout en renforçant les cadres de validation alignés sur la réglementation. Les collaborations stratégiques avec les entreprises pharmaceutiques, les fabricants de dispositifs médicaux et les institutions académiques sont courantes, permettant le co-développement de modèles spécifiques à une maladie. Les fournisseurs investissent également massivement dans l’intelligence artificielle, les architectures basées sur le cloud et les technologies de jumeaux numériques pour améliorer l’évolutivité et l’utilisabilité. La différenciation concurrentielle dépend de plus en plus de la transparence des modèles, de l’acceptation réglementaire et de l’intégration des flux de travail de bout en bout, positionnant l’innovation et la crédibilité comme des facteurs de succès critiques.
Shape Your Report to Specific Countries or Regions & Enjoy 30% Off!
Analyse des Acteurs Clés
- Dassault Systèmes SE
- Insilico Medicine, Inc.
- Certara, Inc.
- GNS Healthcare Inc.
- Novadiscovery SAS
- InSilicoTrials
- The AnyLogic Company
- Immunetrics Inc.
- Abzena Ltd.
- Nuventra Pharma Sciences
Développements Récents
- En janvier 2025, Insilico Medicine a avancé son cadre d’essais cliniques in silico activé par l’IA pour soutenir le développement de Phase II de l’INS018_055, une petite molécule anti-fibrotique. L’entreprise a appliqué des modèles de simulation multimodaux formés sur plus d’un milliard de points de données biologiques et chimiques, intégrant des signatures transcriptomiques et des paramètres pharmacocinétiques pour prédire la réponse à la dose et la stratification des répondeurs avant l’inscription des patients. Le flux de travail in silico a simulé les résultats du traitement sur plusieurs milliers de patients virtuels, soutenant l’optimisation du protocole et la sélection de cohortes informées par biomarqueurs.
- En octobre 2024, Dassault Systèmes a élargi son portefeuille de simulation Living Heart Project pour soutenir la génération de preuves cliniques in silico pour les médicaments et dispositifs cardiovasculaires. La plateforme mise à jour permet des simulations d’électrophysiologie et d’hémodynamique utilisant des modèles cardiaques contenant plus de 5 millions d’éléments finis, permettant une évaluation virtuelle du risque d’arythmie induite par les médicaments et des interactions dispositif-tissu à travers des anatomies spécifiques aux patients. La plateforme intègre des données d’imagerie clinique, y compris des entrées CT et IRM avec des résolutions spatiales inférieures à 1 mm, permettant des cohortes virtuelles réalistes pour des études de simulation de qualité réglementaire.
- En juillet 2024, Certara a publié une version améliorée de son simulateur pharmacocinétique basé sur la physiologie (PBPK) Simcyp™, largement utilisé pour les essais cliniques in silico et les soumissions réglementaires. La mise à jour a élargi les bibliothèques de populations virtuelles pour inclure plus de 40 modèles de population physiologique prédéfinis, couvrant les scénarios pédiatriques, gériatriques, d’insuffisance rénale et d’insuffisance hépatique. Chaque modèle intègre plus de 20 compartiments d’organes avec des paramètres physiologiques spécifiques à l’âge et à la maladie, permettant une évaluation virtuelle du dosage, des interactions médicamenteuses et de la variabilité de l’exposition avant l’exécution clinique.
Couverture du Rapport
Le rapport de recherche offre une analyse approfondie basée sur l’Industrie, la zone Thérapeutique, la Phase et la Géographie. Il détaille les principaux acteurs du marché, fournissant un aperçu de leur entreprise, de leurs offres de produits, de leurs investissements, de leurs sources de revenus et de leurs applications clés. De plus, le rapport inclut des informations sur l’environnement concurrentiel, l’analyse SWOT, les tendances actuelles du marché, ainsi que les principaux moteurs et contraintes. En outre, il discute des divers facteurs qui ont stimulé l’expansion du marché ces dernières années. Le rapport explore également la dynamique du marché, les scénarios réglementaires et les avancées technologiques qui façonnent l’industrie. Il évalue l’impact des facteurs externes et des changements économiques mondiaux sur la croissance du marché. Enfin, il fournit des recommandations stratégiques pour les nouveaux entrants et les entreprises établies afin de naviguer dans les complexités du marché.
Perspectives d’avenir
- L’adoption des essais cliniques in silico continuera de s’étendre à mesure que les sponsors cherchent à réduire les délais de développement et à améliorer l’efficacité des essais.
- La modélisation computationnelle jouera un rôle plus important dans la prise de décision précoce dans le développement de médicaments et de dispositifs médicaux.
- L’intelligence artificielle et l’apprentissage automatique amélioreront encore la précision prédictive et les capacités de conception adaptative des essais.
- L’acceptation réglementaire des preuves basées sur la simulation se renforcera, soutenant une utilisation plus large dans les soumissions et les approbations.
- L’intégration avec des données du monde réel améliorera la prédiction des résultats à long terme et l’évaluation post-commercialisation.
- Les initiatives de médecine personnalisée stimuleront la demande pour des essais virtuels spécifiques aux patients et basés sur des biomarqueurs.
- L’oncologie et la cardiologie resteront des domaines thérapeutiques de premier plan pour les applications avancées in silico.
- Les plateformes basées sur le cloud amélioreront l’évolutivité et l’accessibilité mondiale des outils de simulation.
- La collaboration entre les fournisseurs de technologies, les entreprises pharmaceutiques et les régulateurs s’intensifiera.
- La standardisation des cadres de modélisation améliorera la crédibilité, l’interopérabilité et l’adoption à l’échelle de l’industrie.




