Обзор рынка:
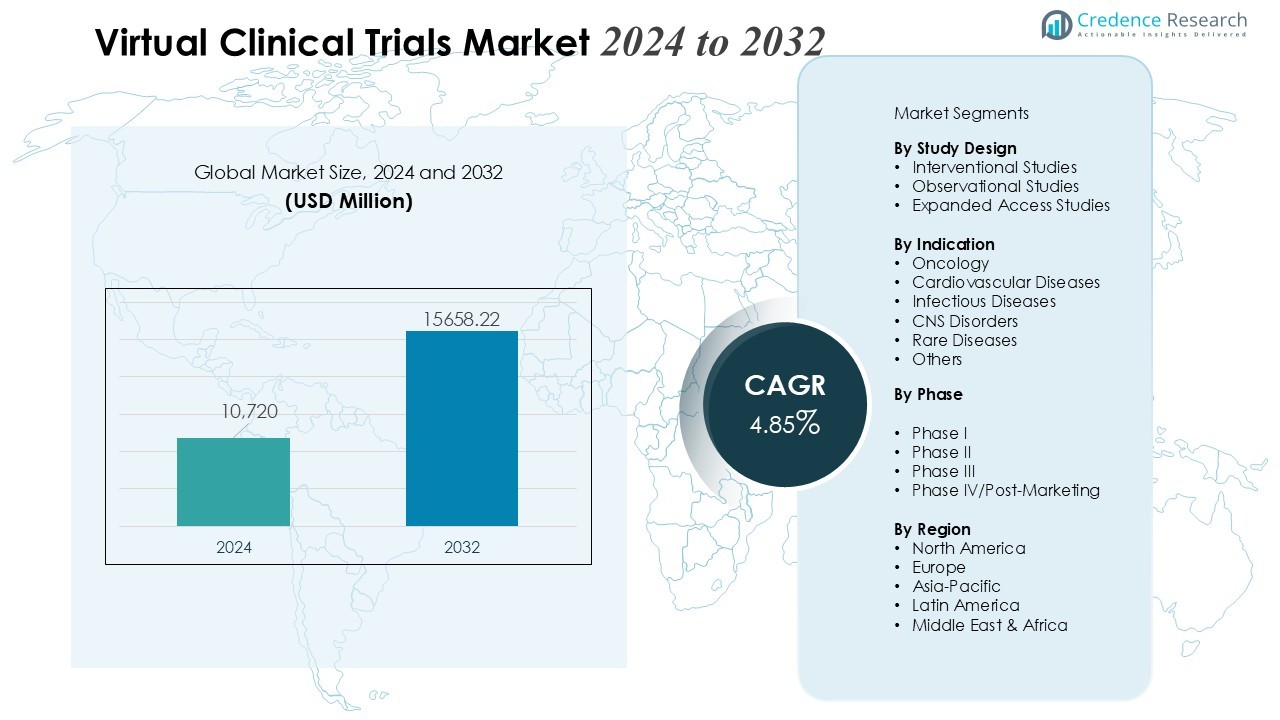
Размер рынка виртуальных клинических испытаний оценивался в 10,720 миллионов долларов США в 2024 году и, как ожидается, достигнет 15,658.22 миллионов долларов США к 2032 году при среднегодовом темпе роста (CAGR) 4.85% в течение прогнозируемого периода.
| АТРИБУТ ОТЧЕТА |
ДЕТАЛИ |
| Исторический период |
2020-2023 |
| Базовый год |
2024 |
| Прогнозируемый период |
2025-2032 |
| Размер рынка виртуальных клинических испытаний 2024 |
10,720 миллионов долларов США |
| Рынок виртуальных клинических испытаний, CAGR |
4.85% |
| Размер рынка виртуальных клинических испытаний 2032 |
15,658.22 миллионов долларов США |
На динамику рынка влияют множество факторов, включая необходимость снижения затрат на испытания, улучшение разнообразия пациентов и повышение уровня удержания. Спонсоры отдают приоритет виртуальным и гибридным подходам для оптимизации сбора данных, расширения географического охвата и минимизации нагрузки на пациентов. Прогресс в области носимых биосенсоров, аналитики данных в реальном времени и облачных электронных оценок клинических результатов (eCOA) улучшает точность данных и операционную эффективность. Возрастающее внимание к моделям исследований, ориентированным на пациента, и увеличивающаяся поддержка со стороны регулирующих органов способствуют дальнейшему внедрению.
Регионально Северная Америка занимает лидирующую позицию благодаря сильной инфраструктуре цифрового здравоохранения, высоким инвестициям в НИОКР и ранней интеграции децентрализованных платформ испытаний. Европа сохраняет значительное участие благодаря поддерживающей регуляторной гармонизации и расширяющимся возможностям удаленных испытаний. Азиатско-Тихоокеанский регион демонстрирует самый быстрый рост, поддерживаемый большими пулами пациентов, расширением проникновения интернета и увеличением аутсорсинговой деятельности в фармацевтической отрасли.
Access crucial information at unmatched prices!
Request your sample report today & start making informed decisions powered by Credence Research Inc.!
Download Sample
Анализ рынка:
- Рынок виртуальных клинических испытаний вырастет с 10 720 миллионов долларов США в 2024 году до 15 658,22 миллионов долларов США к 2032 году, при поддержке CAGR в 4,85%, что отражает устойчивое глобальное принятие децентрализованных моделей исследований.
- Растущий спрос на исследования, ориентированные на пациента, ускоряет внедрение, при этом удаленное участие улучшает набор, удержание и разнообразие в сложных терапевтических областях.
- Давление на эффективность затрат способствует сильному принятию, поскольку децентрализованные проекты снижают накладные расходы на площадки, упрощают рабочие процессы и сокращают сроки испытаний для спонсоров.
- Достижения в области цифровых медицинских технологий, включая носимые устройства, телемедицину, мобильные приложения и мониторинг в реальном времени, повышают точность данных и операционную видимость.
- Регулирующие органы все чаще поддерживают децентрализованные и гибридные модели, предлагая более четкие рекомендации по цифровым конечным точкам, электронному согласию и удаленному сбору данных.
- Основные проблемы сохраняются из-за различий в регулировании, проблем с целостностью данных, ограниченной стандартизации и непоследовательной цифровой инфраструктуры в различных регионах мира.
- Северная Америка лидирует в принятии, Европа расширяется благодаря сильной гармонизации регулирования, а Азиатско-Тихоокеанский регион демонстрирует самый быстрый рост благодаря большим группам пациентов и растущей цифровой связности.
 Драйверы рынка:
Драйверы рынка:
Растущий спрос на модели исследований, ориентированные на пациента
Рынок виртуальных клинических испытаний набирает сильный импульс благодаря переходу отрасли к ориентации на пациента. Спонсоры стремятся уменьшить нагрузку, связанную с поездками, длительными визитами на площадки и ограниченной гибкостью расписания. Это поддерживает более широкое участие, позволяя удаленное взаимодействие и коммуникацию в реальном времени. Удобство для пациента улучшает результаты набора и укрепляет показатели удержания в сложных терапевтических областях.
- Например, исследование mPower компании Sage Bionetworks использовало приложение для iPhone для отслеживания прогрессирования болезни Паркинсона, проводя все наблюдательное испытание удаленно с информированным согласием и измерениями. В инициативе успешно приняли участие 9 500 участников.
Возрастающая потребность в эффективности затрат и ускорении сроков испытаний
Фармацевтические и биотехнологические компании увеличивают принятие децентрализованных подходов для снижения операционных затрат. Рынок виртуальных клинических испытаний получает выгоду от сокращения накладных расходов на площадки, упрощения рабочих процессов и оптимизации распределения ресурсов. Это ускоряет циклы сбора данных и улучшает видимость испытаний для спонсоров и исследователей. Быстрый набор и меньше задержек укрепляют общую производительность разработки.
- Например, спонсор в испытании фазы II, используя параллельную активацию площадок, как описано Геном Ли, сократил количество площадок с 29 до 20, сэкономив более 250 000 долларов на активации и поддержке.
Достижения в цифровых медицинских технологиях и мониторинг в реальном времени
Интеграция телемедицинских платформ, биосенсоров, мобильных приложений и устройств удаленного мониторинга трансформирует проведение испытаний. Рынок виртуальных клинических испытаний использует эти решения для повышения точности данных и соблюдения пациентами. Это позволяет непрерывно отслеживать физиологические показатели и предоставляет более богатые наборы доказательств для клинической оценки. Улучшенная совместимость и облачные системы создают более сильные цифровые экосистемы для крупномасштабных исследований.
Регуляторная поддержка и расширяющееся глобальное принятие децентрализованных моделей
Регулирующие органы на основных рынках поощряют гибридные и полностью виртуальные протоколы для улучшения доступности и устойчивости испытаний. Рынок виртуальных клинических испытаний выигрывает от четких руководящих рамок, усиленного управления данными и улучшенных стандартов валидации для цифровых инструментов. Это способствует более широкому доверию в отрасли и ускоряет глобальное внедрение децентрализованных подходов. Гармонизированные стандарты и трансграничное сотрудничество увеличивают принятие спонсорами в различных терапевтических областях.
Тенденции рынка:
Расширение гибридных моделей испытаний и увеличение использования технологий удаленного мониторинга пациентов
Гибридные модели представляют собой основную тенденцию на рынке виртуальных клинических испытаний, поддерживаемую более широкой интеграцией удаленных и на месте процессов. Спонсоры внедряют гибкие структуры испытаний для балансировки цифрового удобства с необходимыми личными оценками. Это укрепляет набор участников среди разнообразных групп пациентов и расширяет доступ к исследованиям в географически разбросанных популяциях. Носимые устройства, мобильные медицинские приложения и удаленные диагностические инструменты улучшают поток данных и сокращают разрывы в последующем наблюдении. Видимость в реальном времени прогресса пациентов позволяет исследовательским командам быстрее принимать решения. Рост количества облачно подключенных конечных точек также поддерживает соблюдение протоколов и снижает операционные трения.
- Например, основное глобальное испытание вакцины Pfizer против COVID-19 фазы II/III (BNT162b2) включило более 44 000 участников по приблизительно 150 сайтам и контролировало безопасность с использованием комбинации методов, включая электронные дневники, заполненные участниками для ожидаемых реакций, и продолжающееся, слепое для наблюдателей клиническое наблюдение персоналом сайта и независимым советом по мониторингу данных и безопасности для всех неблагоприятных и серьезных неблагоприятных событий.
Внедрение аналитики на основе ИИ, автоматизации и передовых методов валидации данных
Искусственный интеллект, машинное обучение и автоматизированные системы управления данными формируют следующий этап развития рынка виртуальных клинических испытаний. Спонсоры используют предиктивную аналитику для оптимизации подбора пациентов, выявления рисковых паттернов и уточнения сложности протоколов. Это ускоряет проверки качества данных и улучшает надежность оценки результатов. Автоматизация снижает необходимость ручного вмешательства и укрепляет соблюдение нормативных ожиданий. Цифровые платформы вводят более сильные слои валидации для eCOA, ePRO и наборов данных на основе сенсоров. Более широкая интеграция децентрализованных платформ поддерживает глобальную масштабируемость испытаний и повышает уверенность в удаленном создании доказательств.
- Например, платформа на основе ИИ от Clinion интегрирует несколько источников данных, сокращая сроки испытаний через интеллектуальную автоматизацию, при этом поддерживая целостность данных в более чем 100 глобальных исследованиях.
Анализ проблем рынка:
Сложности регулирования, проблемы целостности данных и ограниченная стандартизация
Рынок виртуальных клинических испытаний сталкивается с постоянными проблемами из-за различных интерпретаций регулирования в разных регионах. Спонсоры управляют разнообразными ожиданиями в отношении цифровых конечных точек, удаленного согласия и валидации устройств. Это увеличивает необходимость в точной документации и более сильных следах аудита. Проблемы целостности данных возникают, когда несколько цифровых инструментов работают в разрозненных системах. Ограниченная стандартизация для виртуальных рабочих процессов замедляет согласование протоколов и увеличивает риски несоответствия. Задержки в интеграции и несогласованные руководящие принципы ограничивают более широкое принятие полностью децентрализованных моделей.
Технологические барьеры, цифровой разрыв среди пациентов и операционные ограничения
Различия в цифровой грамотности, доступе к устройствам и подключении создают серьезные препятствия для участия пациентов. Участники рынка виртуальных клинических испытаний выявляют пробелы в обучении, адаптации и технической поддержке для разнообразных групп населения. Это требует постоянного устранения неполадок и увеличения ресурсов для поддержания вовлеченности пациентов. Спонсоры сталкиваются с операционными ограничениями, когда цифровые платформы не обладают совместимостью или безопасными путями обмена данными. Риски кибербезопасности требуют постоянных обновлений и строгих управленческих рамок. Ограниченная готовность площадок и неравномерная технологическая инфраструктура замедляют развитие крупных виртуальных внедрений.
Возможности рынка:
Расширение цифровых терапий, возможностей удаленного мониторинга и испытаний прецизионной медицины
Рынок виртуальных клинических испытаний создает значительные возможности благодаря росту цифровых терапий и моделей прецизионного лечения. Спонсоры разрабатывают стратегии удаленного мониторинга для получения более богатых и непрерывных данных от разнообразных групп пациентов. Это поддерживает проектирование протоколов, требующих частых оценок и персонализированных вмешательств. Рост носимых технологий и аналитики на основе ИИ укрепляет генерацию доказательств для хронических и редких заболеваний. Более широкое принятие децентрализованных моделей открывает доступ к глобальным популяциям, которые традиционные испытания часто исключают. Более сильные цифровые экосистемы позволяют бесшовную интеграцию eCOA, данных сенсоров и телемедицинских услуг.
Масштабирование гибридных рамок испытаний, глобальный охват набора и платформы данных в реальном времени
Гибридные модели предоставляют новые возможности, сочетая контроль на местах с цифровым взаимодействием. Участники рынка виртуальных клинических испытаний получают гибкость для расширения за пределы географических ограничений и набора недопредставленных популяций. Это повышает эффективность исследований, поддерживая непрерывную коммуникацию и удаленное наблюдение. Платформы данных в реальном времени позволяют быстрее интерпретировать клинические конечные точки и ускорять принятие решений. Более сильная совместимость поддерживает многострановые испытания и сокращает операционные задержки. Цифровая зрелость в системах здравоохранения прокладывает путь для более широкого внедрения децентрализованных подходов.
Анализ сегментации рынка:
По дизайну исследования
Рынок виртуальных клинических испытаний демонстрирует сильное принятие в наблюдательных, интервенционных и расширенных моделях доступа. Спонсоры отдают приоритет наблюдательным исследованиям из-за минимальных требований к площадкам и более широкого охвата пациентов. Интервенционные исследования набирают обороты благодаря улучшенным инструментам удаленного мониторинга и структурированным рабочим процессам данных. Это поддерживает соблюдение протоколов, снижая нагрузку на участников. Программы расширенного доступа выигрывают от более быстрого набора и более широкого географического включения.
- Например, RPM-комплекс Science 37 интегрируется с носимыми устройствами для мониторинга жизненно важных показателей в реальном времени в децентрализованных испытаниях, позволяя ИИ-оповещениям выявлять ранние сигналы риска в глобальных исследованиях Фазы II–IV.
По показаниям
Хронические заболевания, онкология и редкие расстройства доминируют в ландшафте показаний из-за высокого спроса на непрерывный сбор данных и модели, ориентированные на пациента. Рынок виртуальных клинических испытаний испытывает сильное притяжение в онкологии, где сложные конечные точки требуют мониторинга в реальном времени. Это повышает соблюдение пациентами и расширяет критерии приемлемости среди удаленных или ограниченных в передвижении групп. Испытания хронических заболеваний выигрывают от носимых биосенсоров и цифровых инструментов соблюдения. Исследования редких заболеваний получают доступ к глобальным популяциям, которые традиционные площадки редко достигают.
- Например, непрерывный монитор глюкозы Dexcom G6 достиг среднего абсолютного относительного различия (MARD) в 9,0% в показаниях уровня глюкозы для испытаний по управлению диабетом.
По фазе
Ранние и поздние фазы испытаний используют децентрализованные подходы для повышения эффективности и улучшения генерации доказательств. Рынок виртуальных клинических испытаний демонстрирует активное участие в исследованиях Фазы II и Фазы III, поддерживаемое большими размерами выборки и необходимостью долгосрочного наблюдения. Это позволяет ускорить проверку данных и обеспечить стабильные показатели удержания. Исследования Фазы I принимают гибридные дизайны для балансировки контроля безопасности с цифровыми инструментами. Постмаркетинговые исследования используют виртуальные платформы для мониторинга реальных результатов в различных популяциях.
Сегментации:
По дизайну исследования
- Интервенционные исследования
- Наблюдательные исследования
- Расширенные доступные исследования
По показаниям
- Онкология
- Сердечно-сосудистые заболевания
- Инфекционные заболевания
- Расстройства ЦНС
- Редкие заболевания
- Другие
По фазе
- Фаза I
- Фаза II
- Фаза III
- Фаза IV/Постмаркетинговая
По региону
- Северная Америка
- Европа
- Германия
- Франция
- Великобритания
- Италия
- Испания
- Остальная Европа
- Азиатско-Тихоокеанский регион
- Китай
- Япония
- Индия
- Южная Корея
- Юго-Восточная Азия
- Остальная часть Азиатско-Тихоокеанского региона
- Латинская Америка
- Бразилия
- Аргентина
- Остальная часть Латинской Америки
- Ближний Восток и Африка
- Страны ССАГПЗ
- Южная Африка
- Остальная часть Ближнего Востока и Африки
Региональный анализ:
Сильное лидерство на рынке в Северной Америке с высокой интеграцией цифрового здравоохранения
Северная Америка сохраняет лидирующую позицию на рынке виртуальных клинических испытаний, поддерживаемую сильной инфраструктурой цифрового здравоохранения и высокими расходами на НИОКР со стороны крупных фармацевтических компаний. Спонсоры в США ускоряют внедрение децентрализованных и гибридных моделей для улучшения набора участников и сокращения задержек испытаний. Это приносит пользу от зрелых телемедицинских сетей, широкой интеграции EHR и сильных стандартов интероперабельности. Регуляторная ясность от FDA укрепляет уверенность в отрасли и расширяет принятие виртуальных протоколов. Продвинутое использование аналитики на основе ИИ, инструментов для мониторинга в реальном времени и подключенных медицинских устройств поддерживает масштабное развертывание. Канада вносит стабильный рост через совместные исследовательские сети и улучшенную цифровую готовность в учреждениях здравоохранения.
Расширяющаяся поддержка регуляторов и быстрая децентрализация по всей Европе
Европа фиксирует значительное участие благодаря гармонизированным регуляторным рамкам и сильным национальным системам здравоохранения. Регион продвигает децентрализованные модели для улучшения доступа пациентов и оптимизации выполнения трансграничных испытаний. Участники рынка виртуальных клинических испытаний получают преимущества от акцента региона на управление данными и безопасные цифровые платформы. Это приносит пользу от высокого уровня цифровой зрелости в Германии, Великобритании и странах Северной Европы. Рост инструментов для удаленного мониторинга и платформ eConsent поддерживает эффективные рабочие процессы исследований. Растущие инвестиции в прецизионную медицину и исследования редких заболеваний расширяют возможности для виртуальных и гибридных дизайнов испытаний.
Самый быстрый рост в Азиатско-Тихоокеанском регионе, поддерживаемый большими пулами пациентов и расширяющейся связностью
Азиатско-Тихоокеанский регион демонстрирует самый высокий темп роста, поддерживаемый большими и разнообразными группами пациентов, а также растущим спросом на доступные клинические исследования. Такие страны, как Китай, Япония, Индия и Южная Корея, укрепляют цифровую инфраструктуру здравоохранения для ускорения принятия децентрализованных испытаний. Участники рынка виртуальных клинических испытаний используют сильный потенциал региона в области набора и быструю урбанизацию. Это приносит пользу благодаря улучшению доступа к широкополосному интернету, более высокой проникновенности смартфонов и расширению сетей телемедицины. Государственные инициативы и государственно-частные партнерства поддерживают создание цифровых доказательств и улучшают регуляторное соответствие. Растущая активность по аутсорсингу и увеличивающиеся инвестиции в биофармацевтику позиционируют Азиатско-Тихоокеанский регион как стратегический центр для расширения виртуальных испытаний.
Анализ ключевых игроков:
- ICON, plc
- Parexel International Corporation
- IQVIA
- Covance
- PRA Health Sciences
- LEO Innovation Lab
- Medidata
- Oracle
- CRF Health
- Clinical Ink
- Medable, Inc.
- Signant Health
- Halo Health Systems
- Croprime
Конкурентный анализ:
Конкурентная среда на рынке виртуальных клинических испытаний включает крупных контрактных исследовательских организаций (CRO), поставщиков технологий и новаторов в области цифрового здравоохранения, которые расширяют децентрализованные возможности через передовые платформы и сильные глобальные сети. Ключевые игроки включают ICON plc, Parexel International Corporation, IQVIA, Covance, PRA Health Sciences, LEO Innovation Lab и Medidata. Эти компании инвестируют в аналитику на основе ИИ, инструменты удаленного мониторинга и унифицированные eClinical платформы для повышения эффективности испытаний и точности данных. Это поддерживает более быстрое привлечение участников, более широкий географический охват и улучшенное удержание пациентов в сложных терапевтических областях. Стратегические партнерства с биотехнологическими компаниями, производителями устройств и поставщиками технологий помогают расширять портфели услуг и улучшать доставку виртуальных протоколов. Конкурентный фокус сосредоточен на интероперабельности, регуляторном соответствии и дифференцированных инструментах взаимодействия с пациентами, которые улучшают масштабируемость и укрепляют лидерство на рынке.
Последние разработки:
- В августе 2025 года IQVIA объявила о долгосрочном клиническом и коммерческом партнерстве с Veeva Systems.
- В октябре 2025 года Parexel расширила свою программу Global Site Alliance, достигнув на 40% более быстрого активации сайтов и в четыре раза большего количества участников на сайт.
Shape Your Report to Specific Countries or Regions & Enjoy 30% Off!
Обзор отчета:
Исследовательский отчет предлагает углубленный анализ на основе дизайна исследования, показаний, фазы и региона. Он подробно описывает ведущих игроков рынка, предоставляя обзор их бизнеса, продуктовых предложений, инвестиций, источников дохода и ключевых приложений. Кроме того, в отчете содержатся сведения о конкурентной среде, SWOT-анализ, текущие рыночные тенденции, а также основные движущие силы и ограничения. Кроме того, обсуждаются различные факторы, которые способствовали расширению рынка в последние годы. В отчете также исследуются рыночная динамика, регуляторные сценарии и технологические достижения, формирующие отрасль. Оценивается влияние внешних факторов и глобальных экономических изменений на рост рынка. Наконец, предоставляются стратегические рекомендации для новых участников и устоявшихся компаний по навигации в сложностях рынка.
Будущий прогноз:
- Рост гибридных и полностью децентрализованных моделей укрепит долгосрочное внедрение в терапевтические области.
- Расширение устройств удаленного мониторинга и инструментов ИИ повысит качество данных и ускорит циклы принятия решений.
- Глобальный охват рекрутинга улучшится, поскольку спонсоры привлекают разнообразные группы пациентов через цифровые платформы.
- Интероперабельность между системами eClinical будет развиваться и поддерживать бесшовную интеграцию данных.
- Регуляторные рамки будут развиваться в направлении более четких стандартов валидации для цифровых конечных точек и удаленных процедур.
- Рост в испытаниях прецизионной медицины увеличит спрос на высокочастотный сбор данных в реальном времени.
- Инвестиции в кибербезопасность и технологии повышения доверия повысят уверенность заинтересованных сторон в виртуальных моделях.
- Укрепление сотрудничества между CRO, поставщиками технологий и биофармацевтическими компаниями будет стимулировать инновации.
- Платформы взаимодействия с пациентами улучшат удержание и снизят уровень отклонений от протоколов в сложных исследованиях.
- Расширение на развивающихся рынках ускорит масштабируемость виртуальных испытаний и увеличит глобальное развертывание.

 Драйверы рынка:
Драйверы рынка:

