Panoramica del Mercato:
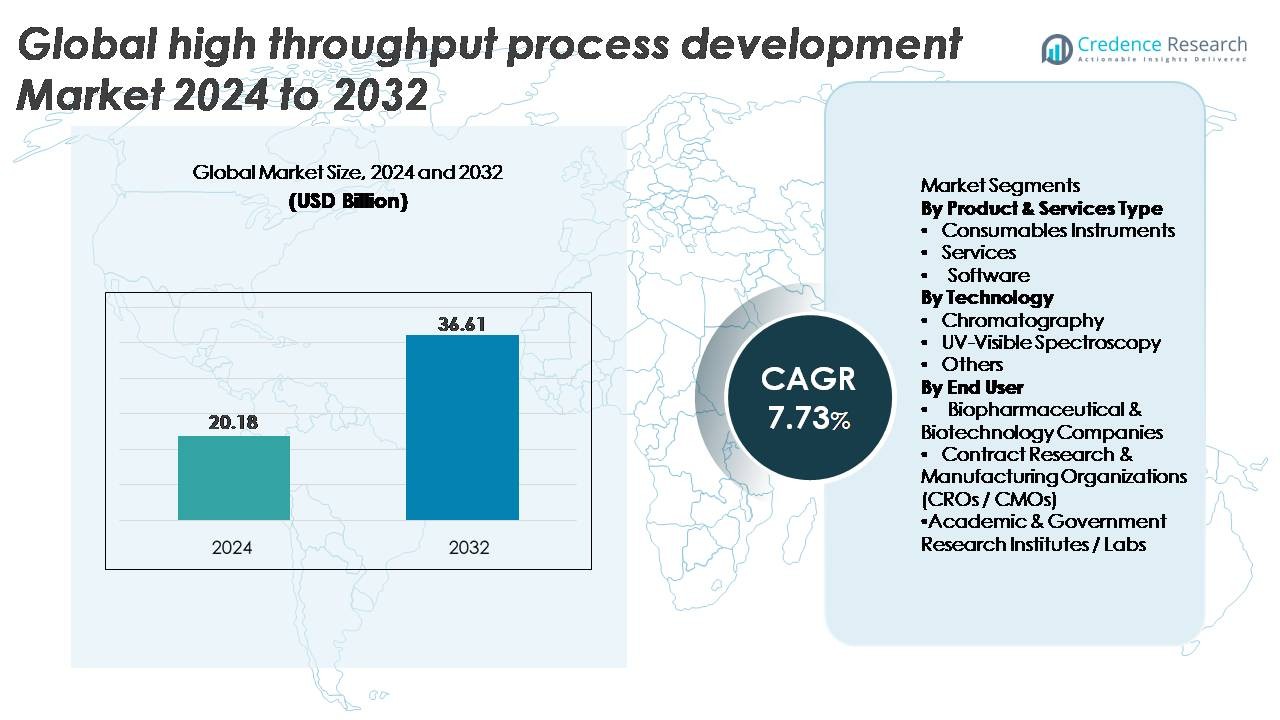
Il mercato globale dello sviluppo di processi ad alto rendimento è stato valutato a 20,18 miliardi di USD nel 2024 ed è previsto raggiungere i 36,61 miliardi di USD entro il 2032, espandendosi a un CAGR del 7,73% durante il periodo di previsione.
| ATTRIBUTO DEL RAPPORTO |
DETTAGLI |
| Periodo Storico |
2020-2023 |
| Anno Base |
2024 |
| Periodo di Previsione |
2025-2032 |
| Dimensione del Mercato dello Sviluppo di Processi ad Alto Rendimento 2024 |
20,18 Miliardi di USD |
| Mercato dello Sviluppo di Processi ad Alto Rendimento, CAGR |
7,73% |
| Dimensione del Mercato dello Sviluppo di Processi ad Alto Rendimento 2032 |
36,61 Miliardi di USD |
Il mercato globale dello sviluppo di processi ad alto rendimento è caratterizzato da un forte gruppo di leader tecnologici, tra cui Sartorius AG, Tecan Trading AG, Thermo Fisher Scientific Inc., Agilent Technologies, Danaher Corporation, Luminex Applikon, Merck KGaA, Eppendorf AG, GE Healthcare e Bio-Rad Laboratories Inc. Queste aziende competono attraverso bioreattori multi-paralleli avanzati, sistemi di cromatografia ad alto rendimento, piattaforme di gestione automatizzata dei liquidi e software analitici integrati che migliorano la velocità e la precisione dell’ottimizzazione dei processi. Il Nord America guida il mercato con una quota di circa il 38%, supportato da un’infrastruttura di R&S biofarmaceutica matura e dall’adozione rapida dell’automazione e della bioprocessazione digitale. L’Europa segue con circa il 29%, trainata da un forte allineamento normativo e da capacità ben consolidate nella produzione di biologici.
Access crucial information at unmatched prices!
Request your sample report today & start making informed decisions powered by Credence Research Inc.!
Download Sample
Approfondimenti di Mercato:
- Il mercato globale dello sviluppo di processi ad alta produttività è stato valutato a 20,18 miliardi di USD nel 2024 e si prevede che raggiungerà i 36,61 miliardi di USD entro il 2032, crescendo a un CAGR del 7,73%.
- La crescita del mercato è guidata dalla rapida espansione delle pipeline di biologici, dalla crescente domanda di screening molecolare più veloce e dall’aumento dell’adozione di bioreattori multi-paralleli automatizzati e sistemi di cromatografia ad alta produttività nella R&S biofarmaceutica.
- I trend chiave includono l’integrazione di analisi predittive basate sull’IA, l’uso più ampio di piattaforme di screening microfluidiche e soluzioni di bioprocessing digitali che migliorano la produttività sperimentale, la robustezza del processo e l’intelligenza dei dati.
- La competizione si intensifica mentre i principali attori innovano in automazione, consumabili e analisi, con il segmento dei consumabili che detiene la quota maggiore grazie all’uso continuo nei flussi di lavoro di screening e purificazione; tuttavia, l’alto costo del capitale rimane un limite per i laboratori biotecnologici emergenti.
- A livello regionale, il Nord America guida con il 38%, seguito dall’Europa al 29% e dall’Asia-Pacifico al 23%, riflettendo forti investimenti in R&S e l’espansione degli ecosistemi di produzione di biologici.
 Analisi della Segmentazione del Mercato:
Analisi della Segmentazione del Mercato:
Per Tipo di Prodotti & Servizi
I consumabili rappresentano il segmento dominante, detenendo la quota di mercato più grande grazie al loro uso ricorrente nello screening rapido, nella preparazione di saggi e nell’ottimizzazione dei flussi di lavoro di cromatografia. Le piattaforme ad alta produttività si basano fortemente su micropiastre, resine, media di filtrazione e reagenti per saggi, rendendo i consumabili essenziali per i cicli continui di sviluppo dei bioprocessi. La loro adozione è ulteriormente guidata dall’espansione dei sistemi di bioreattori multi-paralleli e dei flussi di lavoro di gestione dei liquidi automatizzati che richiedono set di consumabili standardizzati e di alta qualità per mantenere la coerenza del processo. L’intensità crescente della R&S biofarmaceutica e l’aumento della frequenza di screening di cloni, media e buffer rafforzano la forte domanda per questo segmento.
- Ad esempio, il sistema ambr® 250 di Sartorius utilizza consumabili a vaso monouso con volumi di lavoro di 100–250 mL su fino a 24 bioreattori paralleli, mentre le colonne HiScreen di Cytiva consentono fino a 4 mL di volume di resina per colonna per esecuzioni rapide di screening della resina, supportando studi di purificazione ad alta produttività.
Per Tecnologia
La cromatografia rimane la tecnologia dominante, catturando la quota di mercato più grande grazie al suo ruolo centrale nella purificazione, nello screening delle resine e nell’ottimizzazione dei parametri di separazione durante lo sviluppo dei bioprocessi. I sistemi di cromatografia ad alta produttività consentono di esaminare centinaia di condizioni simultaneamente, riducendo significativamente i tempi di purificazione. L’adozione aumenta man mano che i bioproduttori accelerano i programmi di anticorpi monoclonali, proteine ricombinanti e vettori virali che richiedono flussi di lavoro di separazione di precisione. L’integrazione di colonne in miniatura, piattaforme di cromatografia multi-colonna e strumenti di selezione automatizzata delle resine promuove ulteriormente il dominio della cromatografia rispetto alla spettroscopia UV-visibile e ad altri metodi analitici.
- Ad esempio, la piattaforma ÄKTA avant di Cytiva supporta lo screening automatico dei metodi con portate fino a 25 mL/min e accoglie formati di colonne HiTrap e HiScale che vanno da 1 mL a 160 mL, mentre le unità OPUS RoboColumn di Repligen forniscono colonne in miniatura preconfezionate di soli 200 µL, permettendo una rapida valutazione di molteplici chimiche di resine in un’unica esecuzione.
Per Utente Finale
Le aziende biofarmaceutiche e biotecnologiche guidano il segmento degli utenti finali, rappresentando la quota di mercato più grande poiché implementano sistemi ad alta produttività per ottimizzare lo screening delle molecole, la caratterizzazione dei processi e le attività di scale-up. La domanda è alimentata dall’espansione delle pipeline di biologici, inclusi mAb, vettori per terapie cellulari e geniche, e proteine ricombinanti che richiedono cicli di sviluppo dei processi rapidi e ricchi di dati. Queste aziende investono sempre più in bioreattori paralleli automatizzati, sistemi microfluidici e analisi predittive dei processi per accelerare il tempo di arrivo in clinica. Anche CRO/CMO e istituti accademici adottano flussi di lavoro ad alta produttività, ma la loro intensità d’uso rimane inferiore rispetto agli ambienti di R&D biofarmaceutica completamente integrati.
Principali Fattori di Crescita:
Espansione delle Pipeline di Biologici e Domanda Accelerata di Screening delle Molecole
La rapida espansione delle pipeline di biologici—including anticorpi monoclonali, anticorpi bispecifici, proteine ricombinanti e vettori virali—aumenta significativamente la domanda di piattaforme di sviluppo di processi ad alta produttività (HTPD). Le aziende biofarmaceutiche richiedono uno screening rapido e ricco di dati di linee cellulari, composizioni di media, condizioni di buffer e chimiche di resine per ridurre i cicli di sviluppo e migliorare la fedeltà dei processi nelle fasi iniziali. Le tecnologie ad alta produttività consentono esperimenti paralleli, riducendo i tempi di ottimizzazione da mesi a settimane. Inoltre, l’ascesa di nuove modalità come le terapie mRNA, i costrutti di gene-editing e i componenti delle terapie cellulari richiede una caratterizzazione complessa dei processi, rafforzando ulteriormente la domanda di bioreattori multi-paralleli, sistemi di cromatografia automatizzati e strumenti di ottimizzazione microfluidica. Con l’aumento delle aspettative regolatorie per la robustezza dei processi, le aziende adottano l’HTPD per generare dataset completi che supportano i framework di qualità per progettazione (QbD). Questo fattore rimane fondamentale poiché la spesa globale in R&D si intensifica e le pipeline di sviluppo dei biologici si diversificano tra oncologia, malattie rare e immunoterapia.
- Ad esempio, il sistema ambr® 15 di Sartorius consente fino a 48 bioreattori paralleli che operano a un volume di lavoro di 10–15 mL, mentre la piattaforma Beacon® di Berkeley Lights può esaminare più di 3.000 singole cellule simultaneamente, generando dati funzionali in meno di 24 ore, accelerando drasticamente la selezione dei cloni e lo screening iniziale dei biologici.
Crescente Adozione di Automazione, Robotica e Bioprocessing Digitale
L’automazione funge da catalizzatore critico per la crescita mentre le organizzazioni passano dalla sperimentazione manuale a flussi di lavoro robotici potenziati dall’IA. I gestori di liquidi automatizzati, i sistemi integrati di micropiastre e i bioreattori multi-paralleli riducono significativamente l’errore umano, aumentano la produttività e standardizzano il design sperimentale. Le piattaforme di bioprocessing digitale ora incorporano algoritmi di apprendimento automatico per l’ottimizzazione dei parametri, la modellazione predittiva e il controllo adattivo in tempo reale, consentendo una convergenza più rapida verso condizioni di processo ottimali. I sistemi di cromatografia automatizzati e le stazioni robotiche di preparazione dei campioni migliorano ulteriormente l’efficienza della purificazione e la riproducibilità analitica. Queste capacità consentono ai team di sviluppo di valutare migliaia di condizioni in tempi compressi, supportando strategie di triage rapido delle molecole e intensificazione dei processi. La proliferazione della gestione dei dati basata su cloud, dei taccuini di laboratorio elettronici integrati e dei gemelli digitali consente la collaborazione tra siti e accelera il trasferimento tecnologico. Complessivamente, la sinergia tra automazione e digitalizzazione guida l’adozione su larga scala, in particolare all’interno dei centri di innovazione biofarmaceutica e delle organizzazioni di sviluppo a contratto.
- Ad esempio, la piattaforma Microlab STAR di Hamilton offre alta precisione (ad es., precisione tipica di <1,0% e precisione di <0,8% CV a 50 µL) e può elaborare piastre fino a 384 pozzetti con l'opzione MultiProbe Head, consentendo applicazioni ad alto rendimento in genomica e diagnostica clinica.
Crescente Necessità di Accelerare l’Ampliamento e l’Intensificazione dei Processi nella Bioproduzione
Il movimento dell’industria verso una bioproduzione intensificata, continua e flessibile crea una forte domanda di strumenti HTPD che supportano un rapido ampliamento e una definizione robusta dei processi. Mentre le aziende perseguono tempistiche cliniche accelerate e modelli di produzione economici, i sistemi ad alto rendimento forniscono i dataset fondamentali necessari per passare dal banco alla scala pilota con rischio ridotto. I mini bioreattori multi-paralleli consentono l’esplorazione in tempo reale dei parametri critici del processo come pH, ossigeno disciolto, agitazione e strategie di alimentazione dei nutrienti, garantendo prestazioni prevedibili su diverse scale. Allo stesso modo, gli strumenti di purificazione ad alto rendimento consentono una rapida selezione delle resine, l’ottimizzazione delle condizioni di legame e il profiling dell’eluizione. Queste capacità sono essenziali per il bioprocessing continuo, le operazioni basate su perfusione e le strategie di intensificazione a valle. Con la crescente pressione per fornire processi pronti per il commercio in anticipo nello sviluppo, l’HTPD diventa indispensabile per eliminare i colli di bottiglia, migliorare la coerenza dei processi e rafforzare le sottomissioni regolatorie attraverso dataset profondi e ricchi di dati statistici.
Tendenze e Opportunità Chiave:
Integrazione di Analisi Predittive Guidate dall’IA e Modellazione Avanzata dei Dati
L’intelligenza artificiale emerge come una tendenza trasformativa, consentendo approfondimenti più dettagliati su dataset ad alto rendimento e accelerando il processo decisionale. I modelli guidati dall’IA analizzano parametri multidimensionali, identificano interazioni non lineari e prevedono condizioni di processo ottimali con una precisione senza precedenti. Gli algoritmi di apprendimento automatico possono raccomandare disegni sperimentali, segnalare comportamenti anomali e simulare risultati sperimentali, riducendo il carico di lavoro in laboratorio. I gemelli digitali per lo sviluppo dei bioprocessi consentono la simulazione della cinetica di fermentazione, dei profili cromatografici e degli scenari di scalabilità, permettendo ai team di testare virtualmente le condizioni prima di eseguire esperimenti. Questa tendenza sblocca opportunità per una maggiore robustezza del processo, tempi di sviluppo ridotti e documentazione QbD rafforzata. Man mano che i dataset diventano più complessi, specialmente per i processi di terapia cellulare e genica, l’integrazione dell’IA diventa essenziale per gestire la variabilità e identificare i driver di prestazione nascosti. I fornitori che offrono software con analisi integrate, modellazione automatizzata e strumenti di visualizzazione ottengono un vantaggio competitivo significativo poiché la bioprocessazione basata sui dati diventa lo standard del settore.
- Ad esempio, il software BioTek Gen5 di Agilent elabora oltre 10.000 punti dati per lettura di micropiastra e integra moduli di adattamento delle curve abilitati dall’IA in grado di generare modelli cinetici in meno di 30 secondi, mentre la Piattaforma di Analisi dei Dati di Sartorius supporta la modellazione in tempo reale di oltre 200 parametri di processo simultaneamente durante lo sviluppo a monte.
Adozione Crescente di Mini Bioreattori Multi-Paralleli e Piattaforme di Screening Microfluidico
I bioreattori multi-paralleli e i sistemi microfluidici stanno trasformando lo sviluppo dei processi nelle fasi iniziali consentendo di testare centinaia di condizioni simultaneamente con un consumo minimo di risorse. Queste tecnologie scalabili offrono un controllo preciso sulle condizioni di coltura e permettono una mappatura ad alta risoluzione dei parametri critici. Le piattaforme microfluidiche supportano esperimenti a volume ultra-ridotto, riducendo l’uso di reagenti pur mantenendo la rilevanza biologica, rendendole ideali per lo screening dei cloni, l’ottimizzazione dei media e gli studi sulla produzione di vettori virali. Man mano che la produzione si sposta verso modelli intensificati e continui, la necessità di valutazioni a monte rapide ed economiche cresce notevolmente. Questa tendenza crea opportunità per integratori di sistemi, fornitori di consumabili e venditori di software di fornire soluzioni che combinano test paralleli con analisi in tempo reale. Maggiore riproducibilità, ridotta variabilità e costi operativi inferiori posizionano queste piattaforme come abilitatori critici dell’innovazione nei bioprocessi di nuova generazione.
- Ad esempio, il sistema modulare ambr® 250 di Sartorius consente fino a 24 bioreattori paralleli con volumi di lavoro da 100 a 250 mL, mentre le piattaforme microfluidiche come il sistema Nadia di Dolomite Bio possono eseguire fino a 6.000 reazioni a cellula singola incapsulate per chip in un singolo esperimento, espandendo notevolmente la capacità e accelerando lo screening delle varianti.
Sfide Chiave:
Elevati Requisiti di Investimento di Capitale e Complessità di Integrazione
Nonostante i forti vantaggi, i sistemi ad alta capacità richiedono un significativo investimento iniziale in strumenti automatizzati, apparecchiature analitiche, robotica e infrastruttura di gestione dei dati. Le piccole aziende biotecnologiche, i laboratori accademici e i produttori dei mercati emergenti spesso faticano a giustificare i costi associati a bioreattori multiparalleli, piattaforme avanzate di cromatografia e software basati su AI. Le sfide di integrazione aumentano quando si combinano strumenti di diversi fornitori, creando problemi di interoperabilità tra hardware, formati di dati e sistemi di controllo. L’implementazione di queste tecnologie richiede anche formazione specializzata, capacità avanzate di bioinformatica e coordinamento trasversale tra i team di R&D, sviluppo dei processi e produzione. Man mano che le organizzazioni biofarmaceutiche espandono le piattaforme digitali e automatizzate, la gestione del controllo delle modifiche, la validazione e la conformità normativa aggiungono ulteriore complessità. Queste barriere possono rallentare l’adozione, specialmente in contesti con risorse limitate.
Sovraccarico di Dati, Complessità del Flusso di Lavoro e Collo di Bottiglia Analitici
Le piattaforme ad alta capacità generano enormi set di dati, richiedendo sistemi sofisticati di gestione dei dati, potenza computazionale e pipeline analitiche avanzate. Senza un’infrastruttura adeguata, le organizzazioni affrontano colli di bottiglia nella pulizia, normalizzazione, visualizzazione e interpretazione dei dati. Gestire questo volume di dati può mettere a dura prova i sistemi LIMS, ritardare il processo decisionale e aumentare il rischio di incoerenze analitiche. La complessità del flusso di lavoro aumenta con l’aumento della densità sperimentale, richiedendo un coordinamento stretto tra i team a monte, a valle e analitici. Inoltre, la standardizzazione dei protocolli tra gli strumenti rimane una sfida, portando a variabilità e difficoltà nella comparabilità tra studi. La mancanza di competenza nella modellazione statistica e nelle analisi guidate da ML complica ulteriormente l’adozione. Queste sfide evidenziano la necessità di flussi di lavoro armonizzati, ecosistemi digitali robusti e piattaforme analitiche integrate che semplifichino l’interpretazione dei dati e supportino uno sviluppo dei processi efficiente e di alta qualità.
Analisi Regionale:
Nord America
Il Nord America detiene la posizione dominante nel mercato globale dello sviluppo di processi ad alta capacità, rappresentando circa il 38% della quota totale, guidato da forti pipeline di R&D biologiche e dall’ampia adozione di piattaforme di bioprocessing automatizzate e abilitate all’AI. La leadership della regione è rafforzata da un’infrastruttura avanzata di bioproduzione, significativi investimenti in laboratori digitali e l’integrazione precoce di bioreattori multiparalleli e sistemi di cromatografia ad alta capacità. Le principali aziende biofarmaceutiche e CDMO negli Stati Uniti accelerano la domanda dando priorità allo screening rapido delle molecole e alla caratterizzazione robusta dei processi. Quadri normativi di supporto e finanziamenti sostenuti per biologici innovativi rafforzano ulteriormente il vantaggio di mercato della regione.
Europa
L’Europa cattura circa il 29% del mercato globale, supportata da una forte presenza di produttori farmaceutici, istituti di ricerca specializzati e fornitori affermati di tecnologie di bioprocessing. La regione beneficia di significativi investimenti nel bioprocessing continuo, nella digitalizzazione e nello sviluppo intensificato a monte. Paesi come la Germania, il Regno Unito e la Svizzera guidano l’adozione grazie a ecosistemi di produzione di biologici maturi e programmi di innovazione finanziati dal governo. I sistemi ad alta produttività sono sempre più utilizzati per migliorare la selezione dei cloni, l’ottimizzazione della purificazione e gli studi di scale-up, soprattutto nello sviluppo di anticorpi terapeutici e terapie cellulari. L’attenzione dell’Europa alla conformità normativa e alle metodologie di qualità progettata continua ad accelerare l’adozione sia nell’industria che nel mondo accademico.
Asia-Pacifico
L’Asia-Pacifico emerge come la regione in più rapida crescita, contribuendo a circa il 23% della quota di mercato globale, trainata dall’espansione dei centri di produzione di biologici in Cina, India, Corea del Sud e Singapore. La rapida crescita dei biosimilari, dello sviluppo di vaccini e della ricerca sulle terapie cellulari alimenta significativi investimenti nello screening ad alta produttività, nei mini-bioreattori e nelle piattaforme di purificazione automatizzate. I CDMO regionali adottano sempre più strumenti ad alta produttività per servire clienti globali che richiedono tempi di sviluppo accelerati. Le iniziative sostenute dal governo a supporto dell’innovazione biotecnologica, combinate con l’espansione delle capacità di R&S domestiche, rafforzano la domanda tra università, aziende biofarmaceutiche e centri tecnologici. L’ambiente di produzione competitivo in termini di costi dell’APAC accelera ulteriormente l’adozione su larga scala di moderni sistemi ad alta produttività.
America Latina
L’America Latina detiene circa il 6% del mercato globale, con un’adozione graduale guidata da crescenti investimenti nella produzione farmaceutica e miglioramenti nell’infrastruttura biotecnologica regionale. Brasile, Messico e Argentina guidano la domanda poiché istituti di ricerca e alcune aziende biofarmaceutiche incorporano strumenti ad alta produttività per migliorare l’efficienza nello sviluppo a monte e a valle. Sebbene l’adozione sia in una fase iniziale rispetto ai mercati maturi, cresce l’interesse per la sperimentazione automatizzata, i sistemi di flusso di lavoro digitali e le tecnologie analitiche avanzate. La crescente partecipazione alla ricerca clinica globale e l’espansione delle partnership con aziende biofarmaceutiche multinazionali dovrebbero supportare la continua modernizzazione delle capacità di sviluppo dei processi.
Medio Oriente & Africa
La regione del Medio Oriente & Africa (MEA) rappresenta circa il 4% della quota di mercato globale, con un’adozione guidata principalmente dalle attività emergenti di bioproduzione negli Emirati Arabi Uniti, in Arabia Saudita e in Sud Africa. Gli investimenti in parchi delle scienze della vita, impianti di produzione di vaccini e centri di ricerca biotecnologica contribuiscono a un progresso costante. Sebbene i sistemi ad alta produttività rimangano limitati a causa di vincoli di budget e lacune infrastrutturali, le strategie di diversificazione sostenute dal governo stanno aumentando la domanda di tecnologie moderne di sviluppo del bioprocesso. Le collaborazioni con fornitori di tecnologia internazionali e istituzioni accademiche supportano aggiornamenti incrementali nelle capacità di analisi dei processi, screening automatizzato e laboratori digitali nei principali mercati MEA.
Segmentazioni di Mercato:
Per Tipo di Prodotto & Servizi
- Consumabili
- Strumenti
- Servizi
- Software
Per Tecnologia
- Cromatografia
- Spettroscopia UV-Visibile
- Altri
Per Utente Finale
- Aziende Biofarmaceutiche & Biotecnologiche
- Organizzazioni di Ricerca & Produzione a Contratto (CROs / CMOs)
- Istituti / Laboratori di Ricerca Accademici & Governativi
Per Geografia
- Nord America
- Stati Uniti
- Canada
- Messico
- Europa
- Germania
- Francia
- Regno Unito
- Italia
- Spagna
- Resto d’Europa
- Asia Pacifico
- Cina
- Giappone
- India
- Corea del Sud
- Sud-est Asiatico
- Resto dell’Asia Pacifico
- America Latina
- Brasile
- Argentina
- Resto dell’America Latina
- Medio Oriente & Africa
- Paesi del GCC
- Sud Africa
- Resto del Medio Oriente e Africa
Panorama Competitivo:
Il panorama competitivo del mercato globale dello sviluppo di processi ad alto rendimento è caratterizzato da una forte partecipazione di leader nella tecnologia di bioprocesso, specialisti in automazione e innovatori software focalizzati sull’accelerazione dei tempi di sviluppo dei biologici. Le aziende competono avanzando piattaforme di bioreattori multi-paralleli, integrando analisi guidate dall’IA e migliorando i sistemi di cromatografia ad alto rendimento e microfluidica che supportano l’ottimizzazione rapida dello screening e della purificazione. I fornitori leader offrono sempre più soluzioni end-to-end che combinano strumenti, materiali di consumo e software di flusso di lavoro digitale per rafforzare la fidelizzazione dei clienti e semplificare lo sviluppo dei processi. Le collaborazioni strategiche tra aziende biofarmaceutiche, CDMO e fornitori di tecnologia si stanno espandendo, in particolare in aree che coinvolgono il bioprocesso intensificato e continuo. Fusioni e acquisizioni giocano anche un ruolo chiave poiché i giocatori più grandi cercano di acquisire innovatori di nicchia nella microfluidica, bioreattori miniaturizzati e tecnologie di laboratorio autonome. Investimenti continui in automazione, analisi predittiva e piattaforme di gestione dati basate su cloud stanno plasmando un ambiente competitivo focalizzato sulla fornitura di maggiore velocità, scalabilità e riproducibilità per le pipeline di biologici di nuova generazione.
Analisi dei Principali Attori:
- Sartorius AG
- Tecan Trading AG
- Thermo Fisher Scientific Inc.
- Agilent Technologies
- Danaher Corporation
- Luminex Applikon
- Merck KGaA
- Eppendorf AG
- GE Healthcare
- Bio-Rad Laboratories Inc.
Sviluppi Recenti:
- A giugno 2025, Sartorius AG ha lanciato la piattaforma iQue 5 HTS Cytometry, migliorando la velocità e la flessibilità della citometria a flusso ad alto rendimento.
- A novembre 2024, Sartorius AG ha aperto un nuovo Centro per l’Innovazione nei Bioprocessi a Marlborough (USA) per supportare lo sviluppo dei processi e la produzione in suite GMP.
- A gennaio 2024, Tecan Trading AG ha introdotto strumenti digitali per la produttività in laboratorio allo SLAS 2024, inclusa “Next-Gen Introspect,” prevista per il rilascio commerciale nel Q2 2024, mirata a migliorare i flussi di lavoro di sperimentazione ad alto rendimento.
Shape Your Report to Specific Countries or Regions & Enjoy 30% Off!
Copertura del Rapporto:
Il rapporto di ricerca offre un’analisi approfondita basata su tipo di Prodotti & Servizi, Tecnologia, Utente Finale e Geografia. Dettaglia i principali attori del mercato, fornendo una panoramica delle loro attività, offerte di prodotti, investimenti, flussi di entrate e applicazioni chiave. Inoltre, il rapporto include approfondimenti sull’ambiente competitivo, analisi SWOT, tendenze attuali del mercato, nonché i principali driver e vincoli. Inoltre, discute vari fattori che hanno guidato l’espansione del mercato negli ultimi anni. Il rapporto esplora anche le dinamiche di mercato, gli scenari normativi e i progressi tecnologici che stanno plasmando l’industria. Valuta l’impatto dei fattori esterni e dei cambiamenti economici globali sulla crescita del mercato. Infine, fornisce raccomandazioni strategiche per i nuovi entranti e le aziende consolidate per navigare nelle complessità del mercato.
Prospettive Future:
- Le piattaforme ad alto rendimento diventeranno fondamentali per accelerare i cicli di sviluppo di biologici, biosimilari e terapie avanzate.
- I mini bioreattori multi-paralleli sostituiranno sempre più i sistemi tradizionali su scala da banco per lo screening iniziale dei processi.
- Le analisi predittive guidate dall’IA automatizzeranno ulteriormente la selezione delle condizioni, riducendo il carico sperimentale e migliorando l’accuratezza dei processi.
- Le tecnologie microfluidiche si espanderanno, consentendo screening a volume ultra-basso per linee cellulari, media e ottimizzazione dei vettori.
- Le strategie di bioprocessing continuo e intensificato aumenteranno la dipendenza da strumenti di purificazione ad alto rendimento e screening delle resine.
- Le piattaforme dati native del cloud standardizzeranno la collaborazione tra siti e rafforzeranno gli ecosistemi di bioprocessing digitali.
- I CDMO investiranno pesantemente in suite automatizzate ad alto rendimento per supportare tempi più rapidi dei clienti e prontezza alla scalabilità.
- L’integrazione tra strumenti ad alto rendimento upstream e downstream creerà flussi di lavoro di sviluppo più unificati e completi.
- Le aspettative normative per le sottomissioni QbD ricche di dati accelereranno l’adozione di sperimentazioni automatizzate ad alta risoluzione.
- I mercati emergenti nell’Asia-Pacifico guideranno l’espansione globale man mano che le capacità di bioproduzione regionali si modernizzano rapidamente.

 Analisi della Segmentazione del Mercato:
Analisi della Segmentazione del Mercato:

